Volume6 No.1
SPring-8 Section A: Scientific Research Report
プレニル鎖変換に関わる酵素の反応機構の解析
Investigation of the Reaction Mechanism of Prenyl-Chain Transformation Enzymes
a京都大学大学院理学研究科,b名古屋大学大学院生命農学研究科, c京都大学化学研究所
aGraduate School of Science, Kyoto University, bGraduate Schoolo of Bioagricultural Sciences, Nagoya University, cInstitute for Chemical Research, Kyoto University
- Abstract
-
ゲラニルゲラニル基還元酵素(GGR)は、イソプレノイドに存在する二重結合を還元する酵素である。本研究では古細菌Sulfolobus acidocaldarius 由来GGRを対象に、基質であるゲラニルゲラニル二リン酸(GGPP)との複合体構造を決定し、その反応機構を明らかにすることを目指した。BL38B1において、Sa-GGRとGGPPの混合溶液から得た結晶より1.85 Å 分解能のデータを取得したが、基質に相当する電子密度はGGPPとは断定できないものであった。
キーワード: 結晶構造解析、酵素
背景と研究目的:
イソプレノイド化合物は、ホルモン、香料、タンパク質のアンカー脂質、生体膜成分など、生体内で多様な働きを担う化合物群であり、これまでに75000種以上が知られている。我々はこれまでに複数のイソプレノイドの伸長や変換に関わる酵素の構造解析を行ってきた[1-4]。本研究では、古細菌の膜脂質合成に関わるゲラニルゲラニル基還元酵素(GGR)の構造を基質との複合体の形で決定し、その反応機構を明らかにすることを目指した。
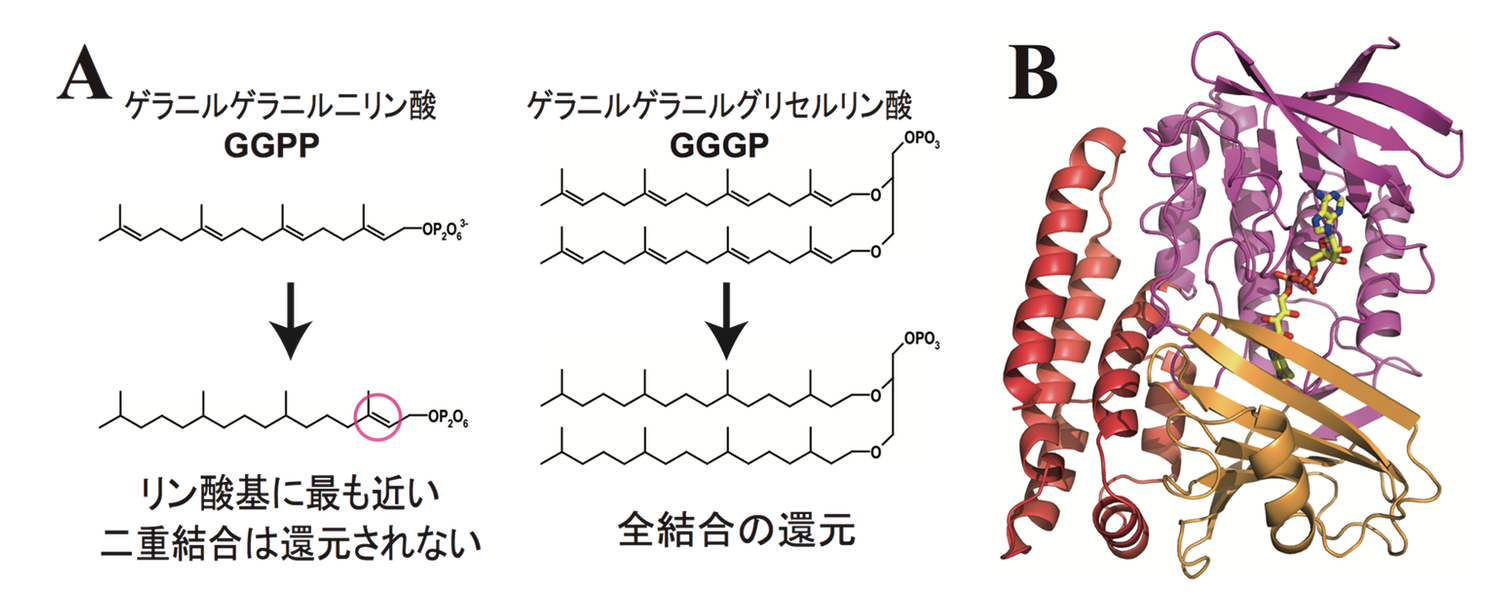
古細菌の膜脂質は、還元されたイソプレノイドがエーテル結合でグリセロールリン酸に結合した化合物で構成されており、真正細菌や真核生物のものとは大きく異なる。本研究で対象とするGGRは、イソプレノイドに存在する二重結合を還元する役割を担うフラビン酵素であることが示されている。具体的にはゲラニルゲラニル二リン酸(GGPP)を基質とするとき、ゲラニルゲラニル鎖に4 つある二重結合のうちの脂質末端から3 カ所のみを還元する。また、ゲラニルゲラニルグリセルリン酸(GGGP)を基質とするときは、ゲラニルゲラニル基中のすべての二重結合を還元する(図1A)。これまでに、Sulfolobus acidocaldarius 由来GGR (Sa-GGR、図1B)[4]とThermoplasma acidophilum 由来GGR[5]の構造が解明されている。
図1. (A) Sa-GGR の触媒する反応。(B) Sa-GGR の全体構造[4]。3つのドメインに分かれている。補因子のFADを stick model で示す。
実験:
以前に我々が決定したSa-GGRの結晶構造では、Sa-GGRをGGPPと共結晶化したにもかかわらず、GGPPの全体に対応する電子密度は見られなかった[4]。これはGGPP(図1A左)が C20 と比較的疎水性の高い化合物であるため水への溶解度が低く、共結晶化に用いた試料中に含まれるGGPP濃度が不十分であったためと考えた。そこで、メタノールと水の混合液にGGPPを溶解させることにより、Sa-GGR (5.2 mg/ml、0.1 mM)とGGPP (1 mM)の混合溶液(mol比 1:10)を作成し、これを共結晶化した。
結晶は以前からの条件と類似の条件(Bis-Tris (pH 6.5)、PEG3000、Calcium acetateを含む)で得られた。実験室のX線を用いた予備測定を 2.6 Å 分解能で行ったところ、GGPP様の基質がGGRのフラビン近傍に結合していることを確認した。そこでこの結晶をBL38B1での実験に供した。
Sa-GGRの結晶は、凍結するとひび割れなどが極めて起きやすい。このため結晶をキャピラリーに封入し、常温でデータ収集を行った。データの取得条件を表1に示す。
表1. Sa-GGR 結晶からのデータ取得条件
| Sa-GGR | |
| beamline | BL38B1 |
| wavelength (Å) | 1.000 |
| attenuator, Al (mm) | 0.3 |
| X-ray transparency (%) | 35 |
| distance (mm) | 230 |
| exposure (sec/frame) | 1.0 |
| oscillation (deg./frame) | 1.0 |
結果および考察:
取得したデータの統計値を表2に示す。HKL2000[6]でデータ処理を行ったところ、分解能 1.85 Å と、比較的良質のデータが得られた。結晶の空間群および格子定数は、以前のSa-GGRの結晶[4]とほぼ同じであった。
表2. Sa-GGR 回折データの統計値
| Sa-GGR | |
| processed frames | 140 frames |
| space group | p212121 |
| cell constants a/b/c (Å) | 63.49/83.42/106.39 |
| resolution (Å) | 50-1.85 (1.92-1.85) |
| # reflection obs./uniq. | 276269 / 48875 |
| redundancy | 5.65 |
| completeness (%) | 100.0 (100.0) |
| I/σ(I) | 21.3 (2.7) |
| Rmerge (%) | 7.3 (64.7) |
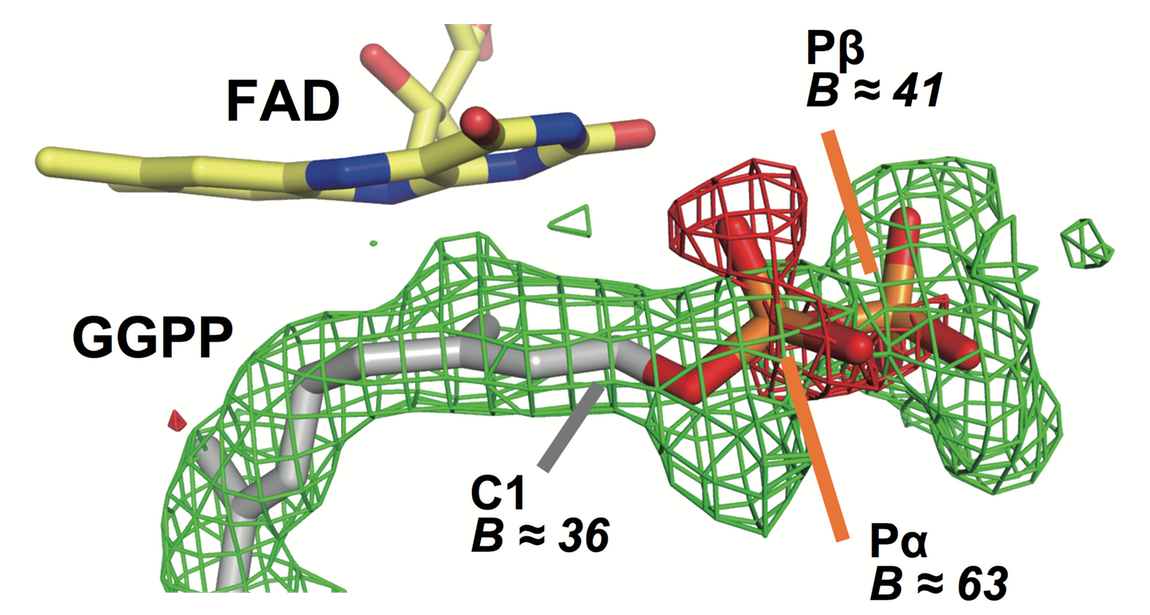
位相は基質非結合型のSa-GGRの構造(PDB ID: 3ATQ)[4]をモデル分子とし、プログラム Molrep[7]を用いた分子置換法により決定した。プログラム coot[8]を用いてフラビン近傍に位置する基質の電子密度にGGPPをあてはめ、R = 15.8%、Rfree = 18.5% までプログラム refmac[9]を用いて構造精密化を行った。しかし、基質に相当する電子密度は、α-リン酸に対応する電子密度が非常に弱いことなどから、GGPPとは断定できないものであった(図2)。
図2. 基質結合部位。緑の mesh は基質GGPPを omit して描画した F0Fc map (3.0σ)。赤の mesh は基質GGPPを含めた Model を基に描画した F0Fc map (-4.5σ)。C1、Pα、Pβ 原子については、おおよその B factor (温度因子、Å) を示している。Pα 原子について、C1、Pβ 原子よりも温度因子が高い上、4.5σ の negative peak (赤の mesh) が現れることは、GGPPをこの位置に mopdeling することの不適切さを示唆する。
今後の課題:
本課題のビームタイムで取得したデータでは、Sa-GGRとGGPP複合体と断定できる構造は得られなかった。今後GGPPの溶液の作成に水以外の溶媒を用いるなどの工夫により、GGPPの濃度を更に上昇させての結晶化などが望まれる。実際、本課題による実験の後、別のグループによるSa-GGRとGGPPの複合体の結晶構造解析がなされた[10]。彼らは約 10 mg/mL (0.19 mM)のSa-GGRに対し、mol比が約26倍の 5 mM GGPPを混合して共結晶化していた。
参考文献:
[1] M. Fujihashi et al., Proc. Natl. Acad. Sci. U. S. A. 98, 4337 (2001).
[2] J. Payandeh et al., J. Biol. Chem. 281, 6070 (2006).
[3] D. Sasaki et al., J. Biol. Chem. 286, 3729 (2011).
[4] D. Sasaki et al., J. Mol. Biol. 409, 543 (2011).
[5] Q. Xu et al., J. Mol. Biol. 404, 403 (2010).
[6] Z. Otwinowski, and W. Minor, Methods Enzymol. 276, 307 (1997).
[7] A. Vagin, and A. Teplyakov, J. Appl. Cryst. 30, 1022 (1997).
[8] P. Emsley et al., Acta Crystallogr. D 66, 486 (2010).
[9] M. D. Winn, M. N. Isupov, and G. N. Murshudov, Acta Crystallogr. D 57, 122 (2001).
[10] Y. Kung et al., Structure 22, 1028 (2014).
謝辞:
本研究を進めるに当たり、佐々木大輔博士には、有益な議論をして頂きました。データ取得に当たっては、ビームラインスタッフのみなさまのお世話になりました。本研究は科学研究費助成事業 基盤研究C (24570130)のサポートなどにより進められました。深謝いたします。
ⒸJASRI
(Received: August 25, 2017; Early edition: October 27, 2017; Accepted December 18, 2017; Published: January 25, 2018)