Volume6 No.1
SPring-8 Section A: Scientific Research Report
巨大ヘモグロビンの酸素結合中間状態の結晶構造解析
Crystal Structure Analysis of the Oxygenation Intermediate States of the Giant Hemoglobin
東京医科歯科大学難治疾患研究所
Medical Research Institute, Tokyo Medical and Dental University (TMDU)
- Abstract
-
ヘモグロビンの酸素結合と解離に伴う構造変化の中間体を構造解析した例はこれまでにない。本研究では、無脊椎動物由来巨大ヘモグロビンの酸素結合型結晶を浸漬法により酸素非結合型へと結晶を破壊することなく移行させ、その中間状態のX線結晶構造解析を行った。得られた結晶構造から酸素の部分的な解離を確認し、本手法の有効性を実証した。また、巨大ヘモグロビンの四次構造変化は、大部分の酸素が解離しない限り生じないことが示唆された。
キーワード: アロステリックタンパク質、構造変化、中間体
背景と研究目的
海底に棲息しているサツマハオリムシやマシコヒゲムシは、その分子量がおよそ40万にもなる巨大なヘモグロビン(Hb)を血液中に有している。われわれはこれまでに、これら巨大Hbについて酸素結合型の結晶構造を解明し、より小型なヒトHb(分子量約6万)とはまったく異なった四次構造をとっていることを明らかにした[1]。さらに、その協同的な酸素結合、解離の機構についても独自の四次構造変化を伴うことを明らかにした[2, 3]。しかしながら巨大Hbは酸素親和性が非常に高く、完全な酸素非結合型(deoxy型)を調製することが難しかったため、完全なdeoxy型での構造解析は遅れていたが、われわれは、巨大Hbの酸素結合型(oxy型)結晶から、結晶の状態を保ったままdeoxy型へと変化させることに成功し、deoxy型での結晶構造解析に成功した[4]。
このように結晶の状態のまま、酸素結合状態を連続的に変化させることができるようになったことにより、適当な条件を設定することで、すべてのサブユニットに酸素が結合したoxy型から、すべてのサブユニットの酸素が解離したdeoxy型に至るまでの種々の中間状態を順次作り出し、それらについて結晶構造を決定できるものと考えられる。このようなoxy型からdeoxy型へと構造変化する際の中間状態を、タンパク質に一切の改変を導入することなく直接とらえて構造解析した例は、ヒトHbをはじめいかなるHb分子においても全く実現されておらず、複数のサブユニットより成るHbが協同的に酸素を結合/解離する際の構造変化の過程を詳細に解明するうえで、非常に大きな進展をもたらすものである。
そこで本研究ではサツマハオリムシ由来巨大Hbについて、酸素結合から解離までの種々の中間状態について結晶構造を決定し、Hb分子が協同的に構造を変化させていく様子を詳細にモデル化することを目的とした。本研究により、巨大Hbのoxy型結晶からdeoxy型へ移行する中間状態の結晶を実際に調製可能であり、協同的な構造変化の過程の時分割解析の実現に向け、基礎的な知見を得ることができた。
実験:
サツマハオリムシは、その血液中に分子量約40万および約360万の巨大Hbを有する。採集したサツマハオリムシの血液から分子量約40万の巨大Hbを精製し[4]、使用するまで-80°Cで凍結保存した。結晶化は、100 mM HEPES-NaOH pH 7.5、10-20% PEG3350を沈殿剤とするシッティングドロップ蒸気拡散法により行った。20-30 mg/mlに濃縮した巨大Hb溶液と、沈殿剤溶液を1:1で混合し、20°Cの恒温庫内で1週間から1カ月静置することにより、鮮紅色のoxy型結晶を得た。これらの結晶を用い、以下の手順でdeoxy型へ移行する中間状態の結晶を作製した。抗凍結剤としてPEG400の濃度をそれぞれ5、10、15%含む結晶化母液に段階的に結晶を浸漬し、次いで、20% PEG400および50 mM 亜ジチオン酸ナトリウム(dithionite)を含む結晶化母液に浸漬した。浸漬後、結晶が鮮紅色から暗紫色へと変化するのが実体顕微鏡下で観察され、deoxy型へ徐々に移行していることが確かめられた。浸漬時間を60、75、90秒とし、直ちに-178°Cの窒素気流中で瞬間的に凍結し反応を停止させ、X線回折実験まで液体窒素内に保存した。
X線回折実験はBL38B1で行った。波長1.0000 Å、振動角0.5°、露光時間2.0秒で180°分の回折データを収集した。検出器はADSC Q315を用いた。得られた回折データはプログラムHKL2000[5]またはXDS[6]を用いて回折強度の積分とスケーリングを行った。位相決定はプログラムMOLREP[7]を用い、モデルの修正と構造精密化はそれぞれプログラムCOOT[8]、PHENIX[9]を用いた。
上記の浸漬法によりoxy型結晶からdeoxy型への中間状態に移行していることを、可視吸収スペクトルから確認するために、BL38B1に備わっているオンライン顕微分光装置[10]を用いて、結晶の吸収スペクトル測定を行った。測定には薄い(数十μm)板状の結晶を用いる必要があるため、回折実験に用いた結晶とは別個に板状結晶を準備し、dithionite溶液への浸漬時間は75秒とした。
結果および考察:
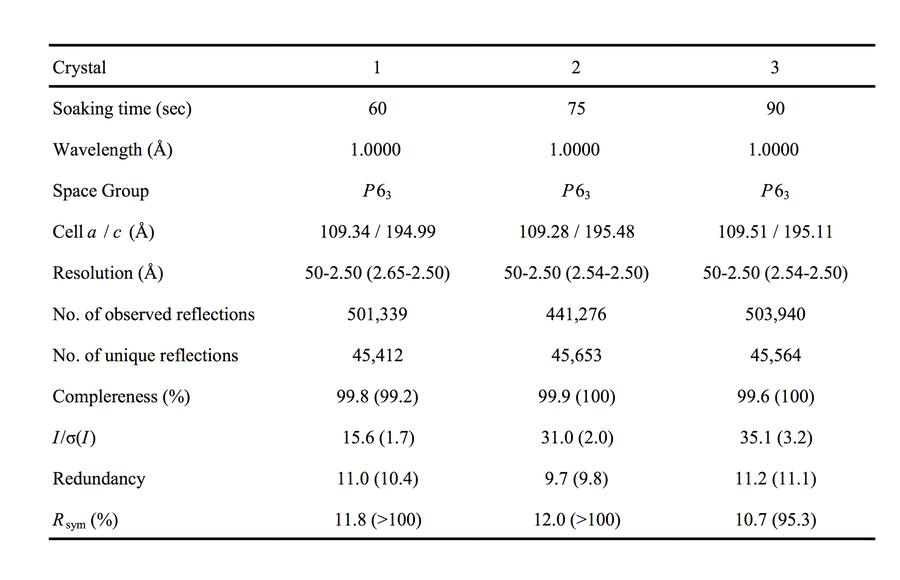
巨大Hb結晶を浸漬法によりoxy型からdeoxy型への中間状態へと移行させる際に、結晶にひび割れなどの損傷が認められる場合もあったが、すべての結晶について、2.5 Å分解能の回折データを収集することができた(表1)。
Table 1 回折データの統計値
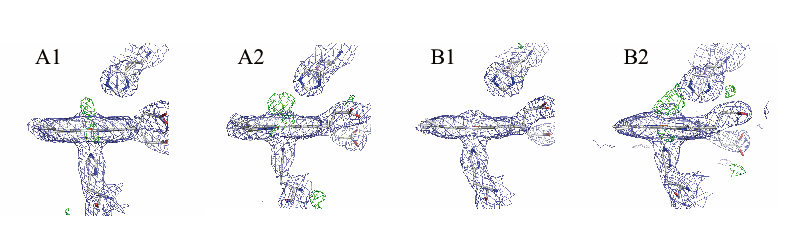
サツマハオリムシ巨大Hbはアミノ酸配列の異なる4種のグロビン鎖(A1、A2、B1、B2)がそれぞれ6個ずつ会合した24量体を形成している。既報のoxy型およびdeoxy型結晶と同様に、結晶の非対称単位中に4種のグロビン鎖がそれぞれ2個ずつ存在していた(すなわち、分子全体の1/3に相当する)。今回の3つのデータセットすべてについて、いくつかのグロビン鎖では酸素分子の電子密度が顕著に減少していることが確認できた(図1)。
図1. 浸漬時間が 75s の結晶における各ヘモグロビン鎖の酸素結合部位の電子密度図。酸素分子をモデル化せずに計算した 2F0-Fc(青、1σ)および F0-Fc(緑、3σ)map を示す。A1、B1鎖では特に、酸素分子の解離が進んでいる。結晶の非対称単位にはそれぞれのグロビン鎖が2つずつ存在するが、そのうちの片方のみを図示している。
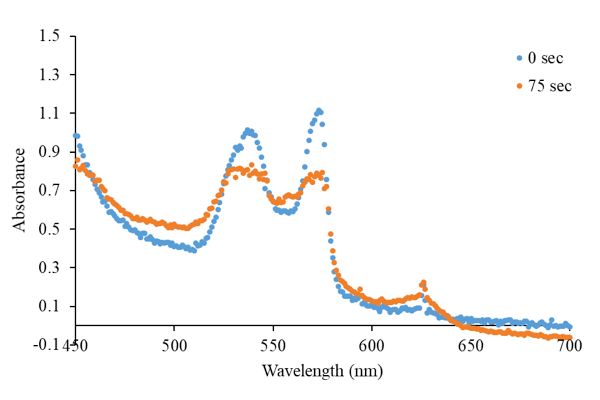
しかしながら、dithionite溶液への浸漬時間と酸素分子の電子密度減少の進行度との相関関係は認められなかった。また、顕微分光による結晶の可視吸収スペクトルからも、本研究での浸漬法によって調製された結晶は、oxy型とdeoxy型との中間状態にあることが確認された(図2)。
図2. 浸漬時間 0 s および 75 s の結晶における可視吸収スペクトル。Dithionite 溶液へ浸漬した結晶では、540 nm および 575 nm 付近の吸収極大に比べ、555 nm 付近の吸収が相対的に大きくなり、deoxy 型の特徴を部分的に有するスペクトルになっている。
サツマハオリムシ巨大Hbにおいても、ヒトHbなどと同様にoxy型とdeoxy型ではその四次構造が異なっており[4]、その構造変化の過程における中間体の構造は、これまで解明されていない。今回得られた構造は、いずれもoxy型に非常に近い四次構造であったため、さらに酸素分子の解離が進まないと大幅な四次構造変化は生じないものと考えられる。
今後の課題:
以上のように本研究では、サツマハオリムシ巨大Hbのoxy型結晶を用い、浸漬法によりdeoxy型へ移行する中間状態の結晶構造解析が可能であることを示した。しかしながら、現状では何割の酸素分子が解離した状態なのかを定量することができていない。酸素分子の電子密度からこれを見積もることは、現状の分解能では非常に困難であり、顕微分光の手法を用いた結晶からの可視吸収スペクトルによる定量が有効と考えられる。しかしながら、分光測定に適した薄い板状結晶からは十分な分解能のX線回折データが得られないことが問題であり、これらを両立させる結晶の調製法の確立が必要である。また、浸漬時間とdeoxy型への移行の進行度との相関関係が認められなかった点は、使用した結晶の体積が一定でないこと、dithionite溶液の還元能が溶液調整後から急速に失われることにより、常に一定の還元能の溶液に調整できていないことなどにより、個々の結晶について浸漬時間とdeoxy型への移行度の関係が異なっていたことが考えられる。今後は、これらの諸条件をより厳密に設定して実験することで、意図した中間状態の結晶を安定的に作製できるよう改善が必要である。
謝辞:
本研究はJSPS科研費25870200の助成を受けたものです。
参考文献:
[1] N. Numoto et al., Proc. Natl. Acad. Sci. USA, 102, 14521 (2005).
[2] N. Numoto et al., Proteins, 73, 113 (2008).
[3] N. Numoto et al., Biochemistry, 47, 11231 (2008).
[4] N. Numoto et al., Acta Crystallogr. D Biol. Crystallogr., 70, 1823 (2014).
[5] Z. Otwinowski, W. Minor, Methods in Enzymology, 276, 307 (1997).
[6] W. Kabsch, Acta Crystallogr. D Biol. Crystallogr., 66, 125 (2010).
[7] A. Vagin, A. Teplyakov, J. Appl. Cryst., 30, 1022 (1997).
[8] P. Emsley, B. Lohkamp, W. G. Scott, K. Cowtan, Acta Crystallogr. D Biol. Crystallogr., 66, 486 (2010).
[9] P. D. Adams et al., Acta Crystallogr. D Biol. Crystallogr., 66, 213 (2010).
[10] N. Shimizu et al., J. Synchrotron Rad., 20, 948 (2013).
ⒸJASRI
(Received: August 17, 2017; Early edition: September 22, 2017; Accepted: December 18, 2017; Published: January 25, 2018)