Volume6 No.1
SPring-8 Section A: Scientific Research Report
高速X線1分子追跡法を使ったタンパク質のフォールディングダイナミクスの解析
Protein Folding Dynamics Based on High Speed Diffracted X-ray Tracking
a東北大学,b(公財)高輝度光科学研究センター, c東京大学
aTohoku University, bJASRI, cThe University of Tokyo
- Abstract
-
タンパク質が変性状態から天然状態にフォールディングする過程の解明を目指し、プロテインAのBドメイン(BdpA)のゆらぎ運動をX線1分子追跡法(DXT法)を用いて観察することを試みた。金基板にBdpAと金ナノ結晶を滴下した試料についてDXT測定を行い、多数の回折点を検出した。変性剤濃度が低い条件では回折点の揺らぎ運動は制限されており、金ナノ粒子と基板の間の相互作用が示唆された。一方で、変性剤濃度が高い条件では比較的速い運動が検出される場合があった。この条件では、変性したBdpAの鎖の揺らぎ運動を観察できた可能性がある。
キーワード: タンパク質のフォールディング、プロテインAのBドメイン、X線1分子追跡法
背景と研究目的:
タンパク質は、ゆらいだ変性状態から折り畳まれた天然状態に自発的に折り畳まれる(フォールディングする)高分子である。変性状態と天然状態の間で二状態的なフォールディング転移を示す小タンパク質において、変性状態と天然状態の間に存在する遷移状態を乗り越える時間(transition path time)はどのくらいかという議論がなされている。一分子蛍光測定によりこの時間が10マイクロ秒以内であるとする報告がされたほか[1]、遷移状態を乗り越える過程を分子動力学計算により再現しようとした結果などが報告された[2]。本研究は、従来とは異なるアプローチを用いてtransition path timeを実測することを目標とし、高速X線1分子追跡法(DXT法)をタンパク質のフォールディング運動の解析に応用することを試みた。
DXT法は、金ナノ結晶をタンパク質にラベル化することで、タンパク質の構造変化を金ナノ結晶の示す回折点の位置変化として計測する手法である(図1)[3]。特に、放射光X線と高速カメラを用いることで、10マイクロ秒の時間分解能での回折点の観測も可能である。測定対象としたのは、プロテインAのBドメイン(B domain of protein A: BdpA)である。BdpAはアミノ酸残基数が62残基であり、三つのヘリックスが束ねられた構造を持つ小タンパク質である。また、二状態の折り畳みを示すことが知られている。我々は、BdpAに蛍光色素をラベル化した試料について一分子蛍光観察を行うことで、天然状態や変性状態における構造揺らぎを報告した[4],[5]。本実験において、金ナノ結晶をラベルしたBdpAを基板に固定してDXT測定を行うことで、transition path timeを計測するだけではなく、天然状態や変性状態におけるダイナミクスの解析が可能になると予想した。
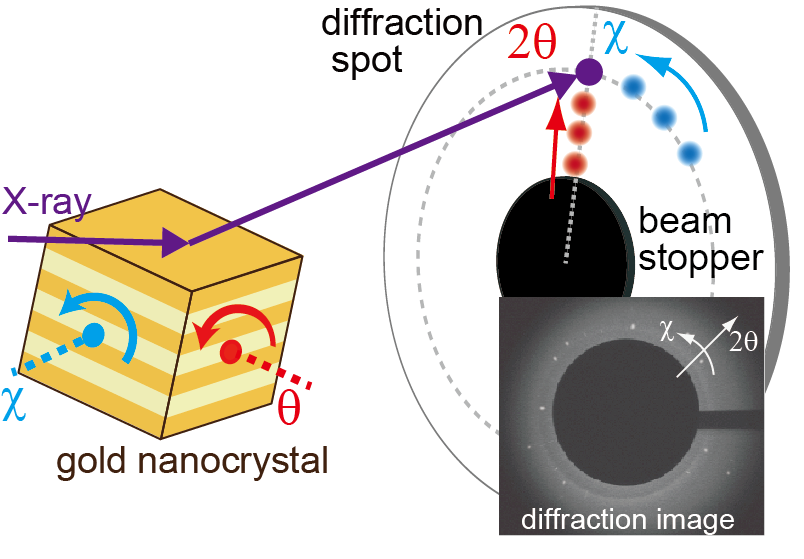
図1.DXT法の測定原理と回折角の定義。金ナノ結晶に入射した白色X線は、X線に対する結晶の角度に応じて回折点を生じる。金ナノ粒子はタンパク質を介して基板に固定されるため、金ナノ粒子の回転運動は、タンパク質の示す揺らぎ運動を反映する。X線の入射位置には多数の金ナノ結晶が存在するため、実際の検出イメージには多数の回折点が観察される。金ナノ粒子が入射X線の軸方向に回転する座標をχ角、動径方向に回転する座標をθ角と定義する。
実験:
BdpAのN末端付近とC末端付近にシステインを導入した試料(K5C/A55C)を作製した。この試料では、二つのシステインがタンパク質の反対側に位置する。システインを還元した変異体のBdpAを金基板に滴下し、さらに金ナノ結晶を添加した試料を作製した。この操作により、金ナノ結晶が片末端にラベル化されたBdpAが、反対側の末端にて金基板に固定されることを期待した。この試料に対して、異なる変性剤濃度の緩衝溶液を滴下した。変性剤濃度がゼロの溶液中ではBdpAが折り畳まれた構造を保つのに対して、グアニジン塩酸塩濃度が3Mでは変性中点付近、グアニジン塩酸塩濃度が4Mの溶液では変性状態にあると期待される[5]。DXT測定にはBL40XUを用い、X-ray Image Intensifier (V5445P, Hamamatsu photonics, Japan)を介してCMOSカメラ (SA 1.1 Photron, Japan) にて回折点を連続計測する実験を、10マイクロ秒の時間分解能と100マイクロ秒の時間分解能にて行った。
結果および考察:
10マイクロ秒の時間分解能によるDXT測定では、回折点の運動はほとんど観察できなかった。しかし、100マイクロ秒の時間分解能における測定では、100マイクロ秒から数ミリ秒の時間領域において揺らぎ運動を行う多数の回折点が検出された。得られた回折点を追跡し、θ角とχ角の座標方向における平均二乗変位を計算した(図1)。異なる変性剤濃度における結果の例を図2に示したが、データの再現性は悪く、同じ条件で計測を行っても平均二乗変位が異なる振る舞いを示す場合もあった。すなわち、本実験手順と条件による測定では、何らかの要因によりデータの再現性が悪いことが示された。
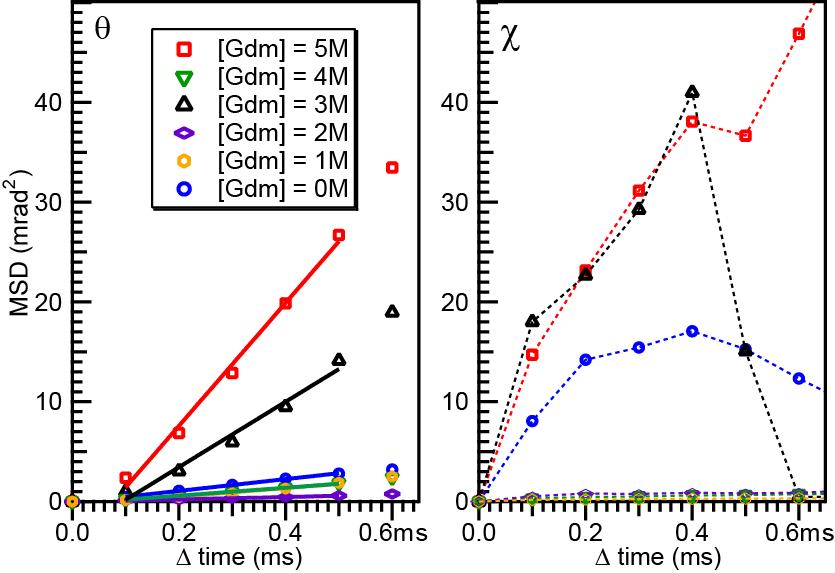
図2.金ナノ結晶とBdpAを滴下した金基板におけるDXT計測結果。グアニジン塩酸塩濃度が0M(青丸)、1M(黄丸)、2M(紫四角)、3M(黒三角)、4M(緑三角)、5M(赤四角)において回折点の運動を多数計測し、得られた時系列データから計算した平均二乗変位(Mean Square Displacement: MSD)をプロットした。左パネルは、θ角方向についての運動、右パネルはχ角方向についての運動を示した。θ角方向における0.1msから0.5msのデータを用いて、回転拡散定数を直線フィットにより計算した。フィットした結果を直線にて示した。
図2に示すデータについて、さらに以下の考察が可能である。第一に、θ角方向については平均二乗変位が時間に対してほぼ直線的に増加したが、χ角方向については、変動がほとんど見られないトレースが多かった。また、χ角方向では不規則な変動を示すトレースもあった。これらの結果は、θ角方向における金ナノ結晶の揺らぎ運動はほぼ拡散的に起きるものの、χ角方向については揺らぎ運動が大きく制約されていることを示している。すなわち、金ナノ結晶が基板表面と直接相互作用することで固定化された状態にあることが示唆される。平均二乗変位の観測データの再現性が良くなかった原因としても、金ナノ結晶と基板との相互作用は試料ごとに異なり、制御が難しいことが挙げられる。このように、得られたデータの多くはBdpAの運動性を直接は反映していないことが示唆された。
第二に、変性剤濃度が5Mの溶液中において得られたデータを検討する(図2、赤)。この条件では、θ角とχ角の両方について平均二乗変位の時間変化が比較的大きかった。金ナノ結晶の運動性の目安として、θ角方向におけるMSDプロットの時間0.1ms から0.5 msの範囲を直線フィットすることで回転拡散定数を算出したところ、変性剤濃度5Mの条件では1.54 × 10-2 rad2/sであった(表1)。得られた回転拡散定数は、グループIIシャペロニンの構造変化(ATP非存在下にて1.28 ×10-5 rad2/s)や、一本鎖抗体の構造変化(抗原非存在下にて2.04 × 10-5 rad2/s)について観察された値よりも明らかに大きかった[6],[7]。一方で、基板に固定せずに溶液中に分散している金ナノ粒子において観察された回転拡散定数(0.28 rad2/s)よりは劇的に小さかった[8]。以上の比較から、変性剤5Mの溶液中において観察された揺らぎ運動は、構造を持ったタンパク質よりは速いけれども、ナノ結晶単体のゆらぎ運動よりは大きく制約されていることが推定できる。すなわち、この条件においては、金基板と金ナノ結晶の間の相互作用が弱まり、両者を架橋したBdpAにより制約された運動が観察されたことが示唆された。
表1. θ角方向の回転拡散定数

一分子蛍光観察実験により、変性したBdpAの揺らぎ運動が10マイクロ秒以内の速い時間領域で起きることが示されている[9]。本研究の結果は、BdpAよりも大きな金ナノ結晶のラベル化により、揺らぎ運動が大きく減速したことを示唆するものである。
結果および考察:
本研究により、BdpAのフォールディング反応をDXT測定により解析するためには、金ナノ結晶と基板の間の相互作用を極力抑える必要があることが示された。ナノ結晶と基板との間の相互作用を再現性よく抑制することは、BdpAが比較的小さいタンパク質であり、変性した場合にはひも状の高分子として振る舞うことを考えると大変難しい。表面効果の低減は、DXT法をタンパク質のフォールディング運動の観察に用いるために解決しなければならない必須の課題である。
一方で、変性剤濃度が高い場合に、変性状態におけるBdpAの運動が観察された可能性が示された。ただし、この条件において、金ナノ粒子と金基板の間に複数個のBdpAが架橋されている可能性も残されている。今後、金ナノ粒子のラベル化方法と、基板への固定化方法の検討も必要である。
本研究を開始するにあたり、DXT法を用いてフォールディング運動のtransition path timeを定量することを目標とした。しかし、この目標の達成は難しいことを指摘したい。DXT法は、試料にラベルされた金ナノ結晶の回転運動を感度よく検出できるが、タンパク質のフォールディングに伴う最も大きい構造変化であるN末端とC末端の距離変化の直接観察は難しい。そのため、タンパク質の変性状態と折り畳まれた状態の変化は、それぞれの状態における回転拡散定数の変化として検出することになる。この場合、一枚の回折像の計測の時間分解能は100マイクロ秒であっても、この計測を一ミリ秒以上継続して回転拡散定数の解析を行わないと、試料がある瞬間に変性状態にあるのか、天然状態にあるのかという判断ができない。従って、マイクロ秒の時間領域だとされるtransition path timeな回折点どをDXT法により実測するには、より小さなナノ結晶を用いてさらに高速の測定を行い、精密な時系列解析が必要となると思われる。
謝辞:
BdpA変異体を作製いただきました新井宗仁博士(東京大学大学院総合文化研究科)に感謝いたします。
参考文献:
[1] H. S. Chung, K. McHale, J. M. Louis, W. A. Eaton, Science 335, 981-984 (2012).
[2] S. Piana, K. Lindorff-Larsen, D. E. Shaw, Proc. Natl. Acad. Sci. USA 109, 17845-17850 (2012).
[3] Y. C. Sasaki, Y. Suzuki, N. Yagi, S. Adachi, M. Ishibashi, H. Suda, K. Toyota, M. Yanagihara, Phys. Rev. E. 62, 3843-3847 (2000).
[4] H. Oikawa, Y. Suzuki, M. Saito, K. Kamagata, M. Arai, S. Takahashi, Sci. Rep. 3, 2151 (2013).
[5] H. Oikawa, K. Kamagata, M. Arai, S. Takahashi, J. Phys. Chem. B 119, 6081-6091 (2015).
[6] H. Sekiguchi, A. Nakagawa, K. Moriya, K. Makabe, K. Ichiyanagi, S. Nozawa, T. Sato, S. Adachi, K. Kuwajima, M. Yohda, Y. C. Sasaki, PLOS One 8, e64176 (2013).
[7] Y. Sato, Y. Tanaka, S. Inaba, H. Sekiguchi, T. Maruno, Y. C. Sasaki, H. Fukada, Y. Kobayashi, T. Azuma, M. Oda, Int. J. Biol. Macromol. 91, 151-157 (2016).
[8] Y. Matsushita, H. Sekiguchi, K. Ichiyanagi, N. Ohta, K. Ikezaki, Y. Goto, Y. C. Sasaki, Sci. Rep. 5, 17647 (2016).
[9] T. Otosu, K. Ishii, H. Oikawa, M. Arai, S. Takahashi, T. Tahara, J. Phys. Chem. B 121, 5463-5473 (2017).
ⒸJASRI
(Received: July 12, 2017; Early edition: September 22, 2017; Accepted: December 18, 2017; Published: January 25, 2018)






