Volume6 No.2
SPring-8 Section B: Industrial Application Report
新規に開発した経皮吸収促進剤が及ぼす皮膚構造への影響
Influence of Newly-Developed Transdermal Absorption Enhancer on the Skin Structure
a旭化成株式会社,b(公財)科学技術交流財団
aAsahi Kasei Corporation, bASTF
- Abstract
-
旭化成が開発した新規の経皮吸収促進剤は、水溶性薬物に対し経皮吸収促進作用を有する。水溶性薬物の経皮透過メカニズムを解明するために、SPring-8の高輝度X線を用いた小角・広角X線回折実験により、経皮吸収促進剤適用時の皮膚の構造変化の観測を試みたところ、製剤適用直後のごく短時間で細胞間脂質ラメラ構造に影響を与えていることを示唆する結果を得た。
キーワード: 経皮吸収、吸収促進剤、皮膚構造、SAXS/WAXS同時測定、時間変化
背景と研究目的:
経皮吸収は注射と比べて侵襲性が低く、嚥下力の弱い高齢者・小児に対して適用できるユーザーフレンドリーで、バイオアベイラビリティ(生物学的利用能)が高い投与経路として注目されているが、水溶性薬物や高分子量の薬物では、角層の透過性がネックとなり著しく吸収性が低いため、これらの薬物に対する経皮吸収性を向上できる技術が望まれている。
旭化成は、これまで経皮吸収製剤化が困難であった水溶性薬物に対して、新規なイオン液体(IL)が経皮吸収促進剤として作用することを見出した[1]。ILを構成する物質が水溶性薬物、及び皮膚に作用し、皮膚の構造に対して何らかの作用を及ぼしていることが考えられるが、その作用を解明できていない。
今回、SPring-8による小角・広角X線回折実験により、皮膚組織の構造変化を捉え、水溶性薬物に対する本経皮吸収促進剤の吸収促進メカニズムを解明することを目指した。
実験:
1) 試料調製
角層:トリプシン処理によりヘアレスマウス凍結皮膚(製品名:ラボスキン、星野試験動物飼育所)から剥離した角層を洗浄・乾燥後、水分 20% 程度に調整したものを使用した。
薬物:ミゾリビン(免疫抑制剤、水/オクタノール分配係数 Log P = −1.9)
基剤:吸収促進剤(新規開発品IL-A–Eの5種類とAZONE [一般名:ラウロカプラム])、2-オクチルドデカノール(OCD)を用いた。
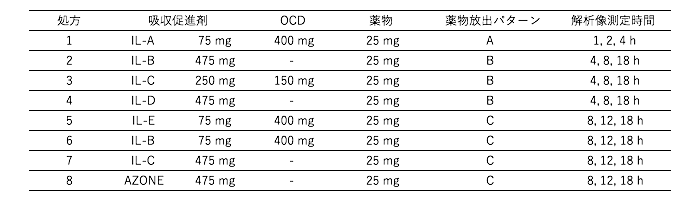
処方:表1の処方で薬物と基剤を混合し、製剤を調製した。
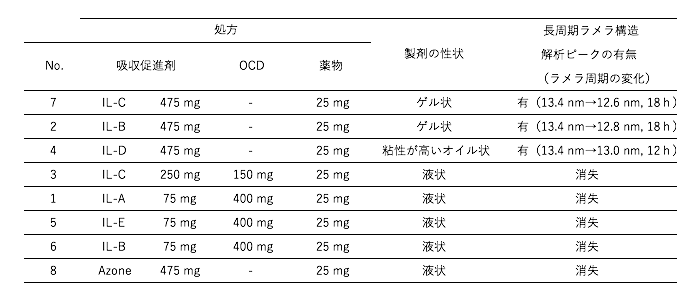
表1.検討処方
2) 測定方法
ガラスバイアル中に予め調製しておいた製剤(粘性の高い液体)にヘアレスマウス角層を浸して、製剤を角層に作用させた。製剤を塗布した角層を ϕ1.0 mm のガラスキャピラリ(リンデマンガラス)に詰め、シリコングリスでサンプルホルダーに固定し、所定の時間にX線回折像を測定し、一次元化処理により、プロファイルを得た。
3) 使用装置・測定条件
SPring-8のBL40B2を利用した。X線の波長は 0.083 nm(15 keV)、カメラ長 490 mm、ビーム径 ϕ200 µm、ビームストッパー ϕ3 mm、イメージングプレートRAXIS-VII(300 mm×300 mm)を用い、実空間 0.28–27 nm の角度領域で小角・広角X線回折像を取得した(露光時間 60 s)。なお、カメラ長の較正にはベヘン酸銀(格子定数 5.853 nm)を用いた。
4) 観測時間の設定
事前に行なったフランツセル試験の結果(図1)から、処方の薬物放出パターンをA、B、Cの3グループに分類し、それぞれで薬物放出が始まる時間、薬物放出が頭打ちになる時間、これらの中間の3点でX線回折像を取得した。
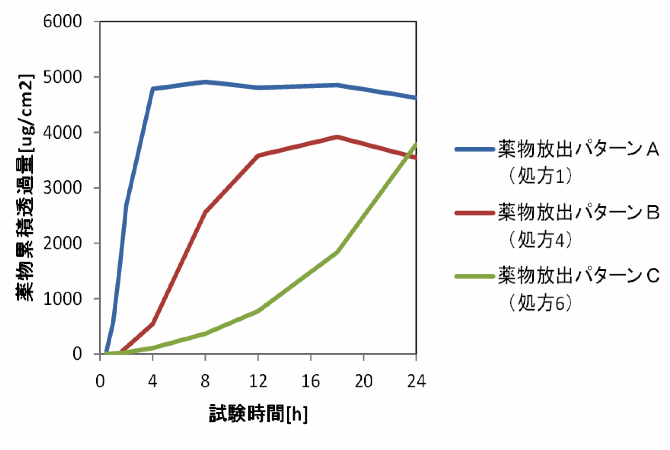
図1. フランツセル試験での皮膚透過性評価
結果および考察:
皮膚構造に由来する回折ピーク[2]として、細胞間脂質ラメラ構造(長周期ラメラ 13.6 nm [0.147 nm-1], 短周期ラメラ 約 6 nm [0.167 nm-1])、細胞間脂質炭化水素鎖充填構造(0.28–0.56 nm [1.8-3.6 nm-1])、ソフトケラチン(1 nm [1 nm-1])に注目すると、細胞間脂質ラメラ構造由来の回折ピークに顕著な変化が見られた。
評価した製剤のうち粘度の低い液状のサンプルでは、最初の観測時に細胞間脂質ラメラ構造由来のピークが消失していた(図2)。一方、粘度の高いサンプルではラメラ構造に由来するピークが消失せず、ラメラ構造のピークが僅かに広角側にシフトしていた(図3)。
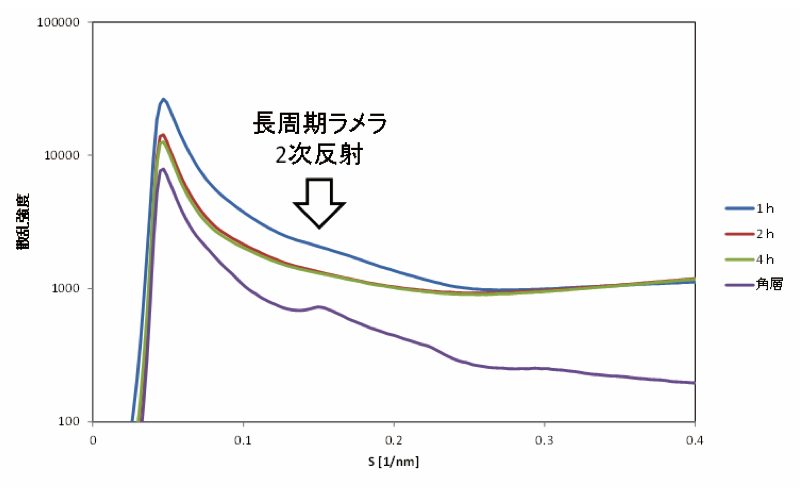
図2. 処方1の回折プロファイル(ラメラ構造由来のピークが消失)
S = (2/λ) sin (2θ/2)、λはX線の波長、2θ は散乱角
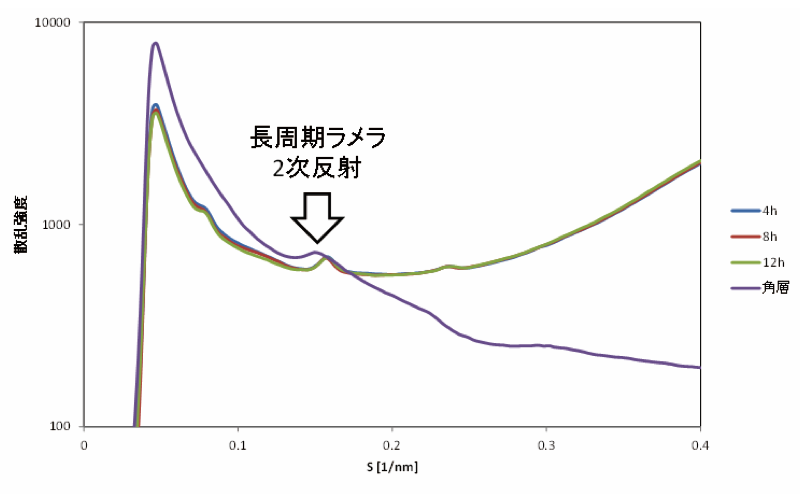
図3. 処方4の回折プロファイル(ラメラ構造由来のピークが広角シフト)
S = (2/λ) sin (2θ/2)、λはX線の波長、2θ は散乱角
この結果から本経皮吸収促進剤は、細胞間脂質に影響を与え、ラメラ周期が短くなっていることが示唆された。また、製剤の粘性が、皮膚構造が変化する時間に関係しており、粘性が低い処方では、製剤の皮膚への浸透が速やかに起こり、ラメラ構造のピークが消失したと推察される(表2)。
表2.ラメラ構造由来回折ピークの消失と製剤の性状の関係
今後の課題:
我々は当初、皮膚構造の大きな変化は、フランツセル試験において薬物の皮膚透過が始まる時間(今回の実験で設定した観測時間の領域)に起こることを予想していたが、粘度の低い製剤では最初の観測(1 h)までにラメラ構造のピークが消失しており、想定していたよりも短い時間スケールで細胞間脂質の構造変化が起きており、より短い時間スケールでの変化を捉える必要があることが判明した。
また、八田らにより開発された“溶液セル”[2]の使用を検討したが、製剤の粘性が高いために、溶液セルへの注入が困難であり、今回の実験では製剤を適用した角層をガラスキャピラリに充填し、複数試料の経時変化を並行して測定した。ガラスキャピラリを用いた測定ではビーム照射位置の固定が困難であり、ビーム照射位置が変わることにより、角層自身の組成(脂質の結晶化の程度など)や付着している製剤量のばらつきのために、明らかなピーク変化あれば検出可能だが、微細な構造変化を捉えることは非常に困難である。皮膚の微細な構造変化を捉えるためには、ビーム照射位置を固定できるセルを用い、高頻度で測定を行うことが必要である。
今後、高粘度の製剤に対応できる溶液セルの改良を行っていく予定である。
参考文献:
[1] 旭化成株式会社出願特許、国際公開番号 WO2016-068336A1
[2] 八田一郎、日本接着学会誌, 52(5), 145 (2016).
ⒸJASRI
(Received: May 10, 2017; Accepted: December 18, 2017; Published: August 16, 2018)






