Volume5 No.2
SPring-8 Section B: Industrial Application Report
皮膚保護機能を備えたストーマ開発を目指したゲル中におけるセラミドの構造解析
Structural Analysis of Ceramide in Gel Matrix, Aiming at the Development of the Stoma with a Skin Protection Function
a群馬大学, b(株)アルケア
aGunma University, bALCARE Co., Ltd.
- Abstract
-
人工肛門(ストーマ)装具の皮膚接触面の多くは、粘着性のゲル製である。この面に皮膚保護機能を持たす目的で、セラミドを配合する製法を検討してきている。皮膚がバリア機能を発揮する際には、セラミドが規則的な分子配列を取ることが必要だと指摘されている。本研究では、ゲル中のセラミドの分子配列を、小角X線回折の手法で調べた。その結果、条件によって、粘着性ゲル中でもセラミドを、皮膚における存在様式に近い分子配列にさせることが出来ると分かった。
キーワード: セラミド、ゲル、小角散乱・回折、ストーマ
背景と研究目的:
皮膚の最外層である角質層は、体内の水分が蒸発することを防ぐ保湿作用とともに、外部から体内への異物の侵入を防ぐバリア機能を担っている。この角質層のバリア機能の要は、細胞間脂質の主要成分であるセラミドと考えられている。角質層内でセラミドは、他の細胞間脂質成分とともに二分子層構造が繰り返すラメラ構造を形成していることがよく知られている。単にセラミドが含まれるといったことだけでなく、セラミド分子が規則的に配列することが、角質層のバリア機能にとって必須であると現在では考えられている[1]。
医療技術の進歩により、今日、人工的臓器の利用者が増加してきている。特に着脱式の人工肛門(ストーマ)は広く普及している。ストーマ装具は、直接皮膚に貼り付く板(面板)と、便を受け止める袋から作られるタイプが一般的である。ストーマ装具の面板は、直接人の皮膚に触れ、かつ、交換のために貼付・剥離を何度も繰り返す必要があるため、これらの皮膚刺激により皮膚がしばしば炎症を起こすことが問題となる。この問題の対処にセラミドが使用できないかと発想し、ストーマ装具の接着面を構成する粘着性のゲル中にセラミドを混入させたタイプの製品の開発・改良を、現在アルケアは進めている。ゲル中のセラミドの構造を、皮膚バリア機能を司る細胞間脂質の構造に近づけることで、ゲルと皮膚の接着面において、一種の人工皮膚のように作用してバリア機能を発揮すると推測している。さらに、ゲルから皮膚へセラミドが移行し、セラミド補給システムとして機能することも期待している。以上のようなことを実現させ、ストーマ装具の面板自体に皮膚保護機能を持たせたいと考えている。
セラミド分子自身は極めて疎水性が強く、単独では水にはほとんど分散せず、結晶を形成して析出することが多い。水和状態でも、セラミド1分子あたりの水分子は最大でも4分子程度と極めて少ない[2]。生物の角質層においてセラミドがラメラ構造を形成する際は、セラミド単独で形成する訳でなく、脂肪酸、コレステロール、コレステロールエステルといった他の分子とともに二分子層構造を作りあげている[1]。そこで、ゲル中において、セラミドが皮膚と同様なラメラ構造を安定的に取るようにさせるためには、第三成分である添加剤の使用をも検討する必要がある。
2015年A期に行った実験の申請時の目標は、ゲル中においてセラミドと助剤(界面活性剤、高級アルコール)を配合した系がどのような分子集合体を形成するかを明らかにすることと、それに加えて、ゲル皮膚貼付時の発汗対応を想定し、水含量を変えた時にセラミド分子集合体の構造が変化するかを調べることであった。ただし、SPring-8 BL40B2で実験する以前に、他の放射光施設でのビームタイムが先にあり、その機会に予定していた実験の一部を先行して実施した。
水の影響に関しては、セラミド分子集合体の構造が、水和の有無によって変化すると報告されている[2]。他の施設で行った我々の実験結果では、試料作成時に存在した水は、製品加工工程における高温(120°C)処理によって、ほぼ完全に蒸発してしまったといえる結果となった。実際の使用時における発汗状況を想定し、作製した試料を37°Cで生理食塩水に24 h浸水させた後、室温20°C前後、湿度50–60%の環境に24 hおいたものを用意し、それら試料と、そのような処理を施していない試料との比較を行った。両者のX線回折パターンには差が見られなかった。この結果より、ゲル中のセラミドを水和させるのは、通常のやり方では困難であると判断し、水和の効果を調べる実験を2015年A期においてSPring-8 BL40B2で実施することは見送った。
助剤を添加した系に関しては、他の施設での実験結果から、幾種類かの添加剤は、セラミドとは混合せず、セラミド分子集合体の構造に影響を与えないことが分かった。その際の実験で結果が明確でなかった4種の添加剤について、SPring-8 BL40B2で再度測定を行った。ここでは、その4種の系についての結果を報告する。
加えて、ゲル中におけるセラミド分子集合体の構造への熱処理の効果についても調べた。先にも述べたように、ゲル試料作製時には120°Cまで加熱する。これに関連して予備的に行った熱測定の実験では、単体のセラミドとゲル中のセラミドでは熱的挙動に違いが観測されていた。具体的には、温度走査速度10°C/minの条件で測定した示差走査熱量測定では、ゲル中のものの方が融解の際に観察される熱異常曲線の頂点温度で比較して、その温度が約10°Cほど低下することが観察された。ただし、単体のセラミドの熱的挙動と、皮膚角質層内でのセラミドの熱的挙動には差があるのも事実である[3]。そのことを踏まえて、ゲル中のセラミド分子集合体の構造に対する温度処理の効果についても調べることとした。
本報告の「結果および考察」の部分では、議論の進め方の関係から、先に熱処理の効果について述べ、次に添加剤の効果について記述する。
実験:
X線回折は、SPring-8の小角散乱・回折ビームラインのBL40B2で、波長0.082 nmの放射光ビームを使って行った。カメラ長は約540 mmで、ベヘン酸銀の回折パターンに基づいて算出した。回折像は、イメージングプレート検出器(RIGAKU R-AXIS IV++)で記録した。露光時間は20 sから90 sの範囲で、標準的には80 sの露光時間で実験を行った。2次元回折像から、1次元のプロファイル(強度-波数曲線)への変換は、ステーション責任者の太田昇博士作製のプログラムを用いて行った。サンプルは、製品加工過程における温度操作を考慮し作製した。セラミド、または事前に融解混合させたセラミドと添加剤の混合物を、ゲル基材の樹脂と一緒にし、その後、セラミドの融点以上の120°Cの温度まで加熱することで両者を混合させ、0.50 mmの厚みのシートに成形した。その後それを室温で保管したものと、さらに60°Cにおいて数日間保った後、再び室温に戻したものの2種類を用意した。サンプル温度は、InstecのHCS302加熱冷却ステージを使ってコントロールした。製品におけるゲルシートの厚さは約0.10 mmであるが、質量比でいって試料全体の10分の1以下の分量の少量成分であるセラミドからの回折を十分な強度で得るために、本実験では厚さ0.50 mmのシートを作製し実験を行った。添加剤を加えた試料では、セラミドに対する添加剤の割合は、全て10∶90とした。
結果および考察:
製品加工工程においては、ゲルを120°Cに加熱する。これは、ゲルの接着性を生み出すためにも必須の操作であるとともに、セラミドを融解させて完全に混合させることも意図している。今回は実際に120°C の温度で、セラミドのみを含むゲル試料でX線回折測定を行ったが、予想通り、ゲルからの散乱を除いて何一つ回折ピークは観察されず、ゲル中のセラミドは完全に融液状態になっていることが確認できた。
温度120°Cまで加熱したものを約30分以内に室温に戻したサンプルの回折パターンは、小角領域に比較的幅広の回折ピークが観察された(図1)。ピーク位置から、周期長は4.29 nmと計算された。また、広角領域の炭化水素鎖の充填構造由来する回折ピーク(S=2.4 nm−1, 周期0.417 nm)も、図2に示した加熱後、60°Cで温度処理した試料のものと比較すると、かなり幅広なものしか観察されなかった(図1)。
ヒト皮膚角質層のX線回折のプロファイルは、年齢の差、肌荒れの状況などの差によって、多少異なることが報告されている[4, 5]が、概ねヘアレスマウスの皮膚角質層で観察されるX線回折プロファイル[5, 6]に近いものである。その特徴としては、タンパク質由来の幅広な散乱に加えて、細胞間脂質由来の比較的シャープな回折ピークが、小角と広角領域に観察されることが挙げられる。具体的には、小角領域に約13 nmと約6 nmの周期をもつ回折ピークと、広角領域(S=2.5 nm−1周辺)に測定温度に応じて一つないしは二つの回折ピークが観察される。実際の皮膚角質層においては先にも書いたように、セラミドだけでなく他の細胞間脂質成分との混合系になっているため、セラミド単独系とは小角領域の回折パターンはかなり異なる。そこで、ここでは主に広角領域の回折ピークに関して考察する。
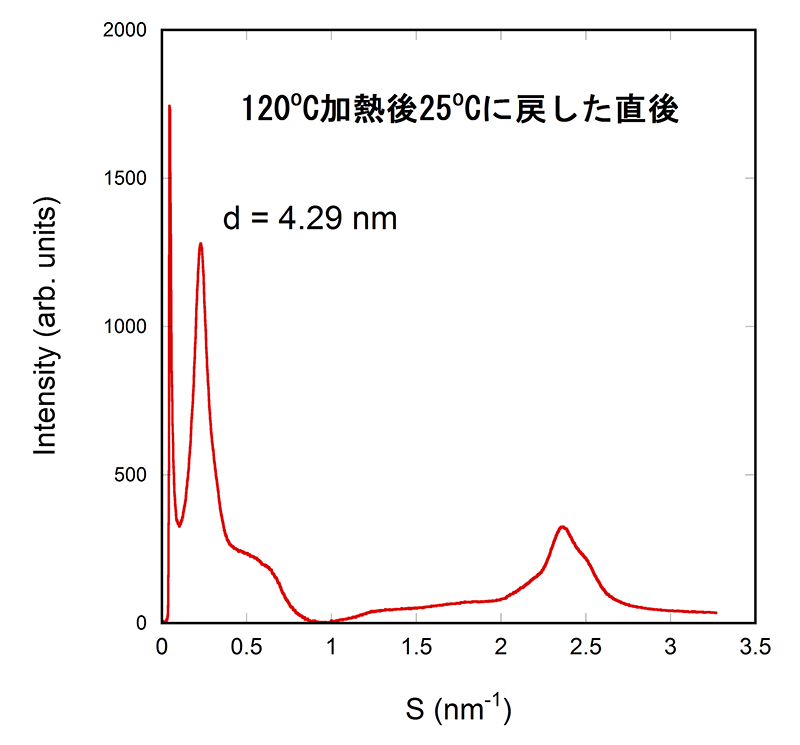
図1 ゲル中におけるセラミドからの小角X線回折パターン。サンプルは一度120°Cまで加熱後、温度を25°Cに戻し温度が安定した直後に、25°Cで回折像を記録した。横軸はS=2sinθ/λ(2θは、回折角、はX線の波長である)である。セラミドを含まないゲルのみの散乱パターンを、バックグラウンドとし、それを差し引いたものを示している。
加熱後急冷したサンプルの広角のピーク(図1)は単一ではなく、肩をもつことから半値幅を正確に見積もることはできないが、その値はSの値でいって0.25 nm−1程度である。文献[5]に掲載されているヒト皮膚角層のX線回折のデータの図からは、S=2.4 nm−1付近の位置に観察される対応するピークの半値幅は、約0.04 nm−1程度であると読み取れる。半値幅のデータだけから断言することはできないが、ゲルを120°Cに加熱後、直ちに室温に戻したゲル中のセラミド分子は、皮膚角質層における配列状態と比較すると、かなり乱れていると判断できる。
一方、120°C加熱後60°Cで温度処理したサンプルを温度25°Cで測定したところ、広角領域には矢印で示したように、比較的鋭い回折ピークが二つ観察された(図2の矢印で示したもの)。これはゲル中でセラミド分子が、温度25°Cでヒトの皮膚角質層内の細胞間脂質が形成する直方晶系(斜方晶系)の2次元規則格子[5, 6]と同様な規則構造に充填したことを示唆している。ただし、ここでゲル中のセラミドにおいて観察されたこれらの回折ピーク(図2の矢印で示したもの)の周期は、それぞれ0.456 nmと0.385 nmであり、ヒトの皮膚角質層の場合で観察される周期0.417 nmと0.370 nmとは必ずしも一致はしない。これは脂質成分の存在の影響のためと考えられる。
急冷した試料の小角領域のプロファイルに関しては、高次回折ピークが明確には観察されなかった(図1)が、温度60°Cで処理した試料では図2に数字を書き入れたように、4次回折ピークは強度が弱いためか観察されていないが、5次までの高次回折ピークが観察されている。これはセラミド分子の2分子層が規則正しく何層にも積層した状況になっていることを示している。ヒトの皮膚角質層の場合では、高次回折ピークがX線回折では観察されることは珍しいが、電子顕微鏡観察からヒト皮膚角質層内で細胞間脂質は、その分子層が何層にも積層した状況(ラメラ構造)を作って存在することが確認されている[4]。ゲル中のセラミドもそれに近い形になっていることが示唆される。
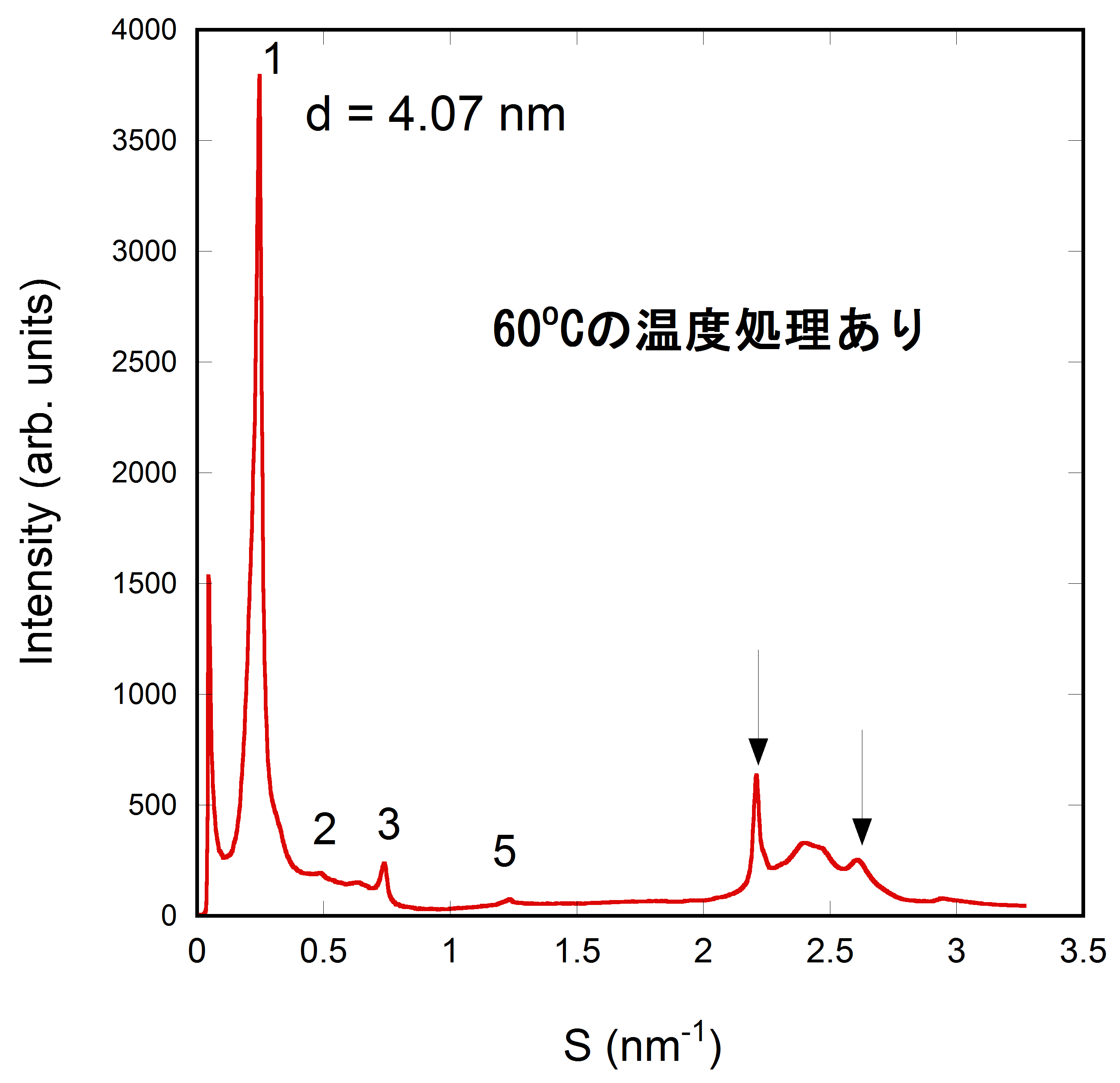
図2 ゲル中におけるセラミドからの小角X線回折パターン。サンプルを一度120°Cまで加熱後、60°Cで6日間保存した後に温度を25°Cまで冷却した。そのサンプルの回折像を25°Cで記録した。横軸はS=2sinθ/λ(2θ は、回折角、λはX線の波長である)である。セラミドを含まないゲルのみの散乱パターンをバックグウランドとし、それを差し引いたものを示している。
炭素数で10以上の比較的長い炭化水素鎖を持ち、かつ、親水部を持つ両親媒性分子、例えば、脂肪酸などの2分子層が直方晶(斜方晶)の2次元規則格子を組む場合は、分子は長周期方向に対して傾くことが多い。そのため、分子の最大長の2倍の長さよりも長周期が短くなる。図2に示した加熱後、60°Cで温度処理した試料の長周期が4.07 nmと、図1の温度処理していない急冷した試料の値4.29 nmよりも短い理由は、セラミド分子の傾きによるものと考えられる。セラミドに限らず、脂肪酸やアシルグリセロールでも同様な現象は観察されている[7]。
本実験で使用したストーマ装具の接着面に相当するゲル中においても温度処理を施すことで、セラミド分子を皮膚の角質層内における存在様式に近い状態にさせることが出来ると分かった。少なくとも層内の側方におけるに充填構造は、皮膚の角質層の細胞間脂質と同じく直方晶系(斜方晶系)の2次元規則格子であった。アルケアにおける予備的な試験でも、このセラミドを含むゲルの皮膚保護機能は確認されている。試験方法としては、皮膚の経皮水分蒸散量、および水分量を測定することで評価し、保護機能があると判断した。
次に添加剤の影響に関して調べた結果を述べる。SPring-8での実験で検討した添加剤は、不飽和高級アルコールのオレイルアルコール、分岐鎖高級アルコールのオクチルドデカノール、脂肪酸ポリグリセリルのステアリン酸ポリグリセリル-4、脂肪酸ポリエチレングリコールのモノステアリン酸ポリエチレングリコールの4種類である。
このうち、ステアリン酸ポリグリセリル-4の結果のみ傾向が異なった。図3に示したものは、ステアリン酸ポリグリセリル-4を添加した場合のX線回折パターンである。長周期構造の回折ピークとして、周期長7.32 nmと4.65 nmに対応する位置に観察された。また、セラミド二重層内の側方の分子充填構造を反映する広角領域の回折ピークは唯一、距離0.413 nmに対応する位置に観察された。一方、高エネルギー加速器研究機構・放射光科学研究施設・フォトンファクトリー・BL10C(課題番号2015G093)で測定したセラミドの粉体試料では、小角領域に長周期5.93 nmと5.50 nmに回折ピークが観察され、広角領域の炭化水素の充填構造の由来の回折ピークとして、距離0.41 nmと0.37 nmの2種類が観察され、この図1の結果とは異なるものであった。また、先の図1および図2に示した、ゲル中にセラミドのみを含む系で観察されたセラミド分子集合体に由来する回折ピーク(周期長4.29 nm, 4.07 nm や0.456 nm, 0.385 nm)に対応するものも観察されなかった。
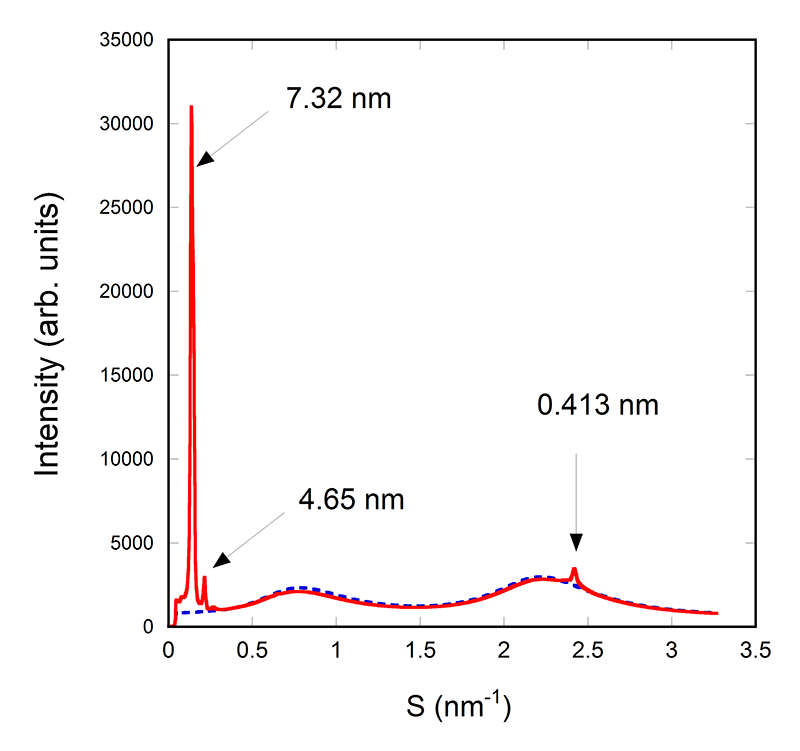
図3 ゲル中におけるセラミド・ステアリン酸ポリグリセリル-4混合系(赤い実線)と基材であるゲルのみ(青い波線)からの小角X線回折パターン。横軸はS=2sinθ/λ(2θ は、回折角、λはX線の波長である)である。
以上の観察事実から、ゲル中においてセラミドとステアリン酸ポリグリセリル-4は相溶し、ないしは、少量のステアリン酸ポリグリセリル-4がセラミド分子集合体の中に取り込まれ、単体で構成されるセラミド分子集合体や、ゲル中でのセラミド単独系とは異なる構造の分子集合体が形成したと考えられる。しかしながら、観察された長周期構造からの各回折ピークの周期長は、整数比等でなく、現時点では指数付けは出来ておらず、ゲル中でセラミドとステアリン酸ポリグリセリル-4が作りだす構造の詳細は不明であり、幾つかの異なる構造が共存している可能性がある。図3には基材であるゲルのみの回折プロファイルも一緒に示したが、セラミドや添加剤の存在によって、ゲルの構造が大きく変わることはないということも確認できた。
ステアリン酸ポリグリセリル-4と異なり、添加剤として、オレイルアルコール、オクチルドデカノール、モノステアリン酸ポリエチレングリコールを用いた場合では、図4に回折パターンを示したように、単体のセラミドに対応する回折ピークが観察された。図4に点線で示した位置は、図2に示した温度処理したゲル中におけるセラミド単独系で観察されたセラミド二分子層の長周期構造の1次回折ピーク、および、層内の側方の分子充填構造を反映する回折ピークに対応する。小角側の点線の位置に対応する周期は4.07 nmであり、広角側は距離0.454 nmに対応する。後者は図2において矢印で示したピークの内の小角側にあるものである。3試料とも、点線のある位置に回折ピークが観察されている。つまり、添加剤と混合せずに、セラミドが単独でゲル中に存在していることを示している。モノステアリン酸ポリエチレングリコールの系では、セラミドの回折ピークと別に、幾つかの回折ピークが観察された(図中で星印を付けたもの)。しかしながら、それらがどの様な構造を反映しているかは、現時点では不明である。
添加物の実験の結論の一つは、検討した添加物の内、少なくともオレイルアルコール、オクチルドデカノール、モノステアリン酸ポリエチレングリコールは、ゲル内でセラミドが安定的にラメラ構造を形成するための助けには寄与しない、ということである。
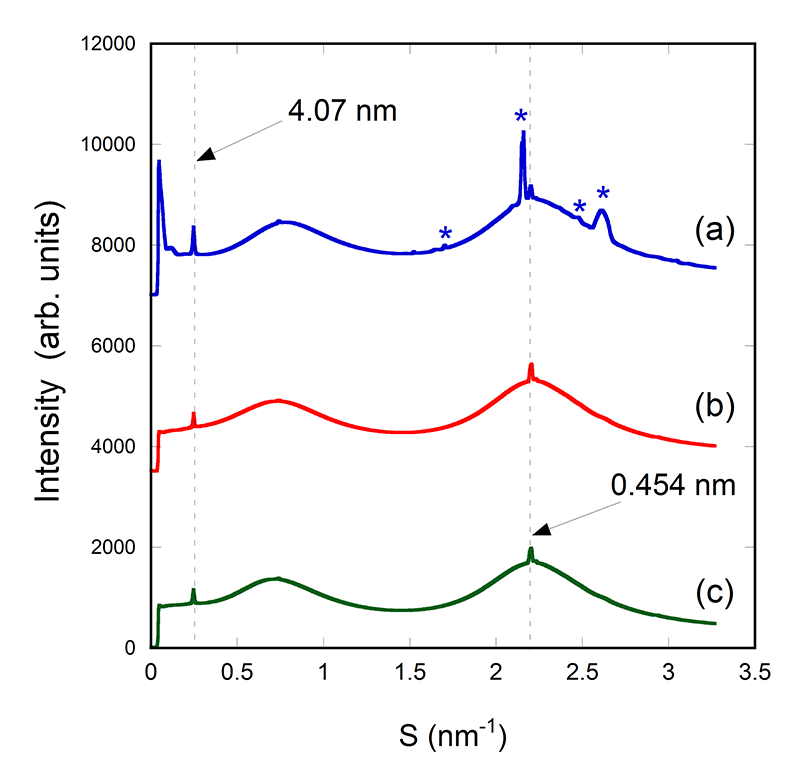
図4 ゲル中におけるセラミド・添加剤混合系からの小角X線回折パターン。添加剤は、(a) モノステアリン酸ポリエチレングリコール、(b) オレイルアルコール、および、(c) オクチルドデカノールである。横軸はS=2sinθ/λ(2θ は、回折角、λはX線の波長である)である。見やすくするために、(a)、(b)の回折パターンには一定強度を足して表示してある。
今後の課題:
実際の製品としては、セラミド単体のみならず、より効果を高めるための添加助剤の使用を考えている。そのような助剤によるセラミド集合体に対する影響を調べる実験では、ここで調べたものの内、ラメラ構造を安定化させる効果がほとんど見られない助剤は特定できたが、ステアリン酸ポリグリセリル-4の場合は、結論として効果の有無ははっきりしていない。その理由は、明瞭な回折像は得られているが「結果および考察」のところで述べたように、詳細構造の解明には至っていないためであり、この解明が今後の課題の一つである。
参考文献:
[1] B. Forslind, M. Lindberg, “Skin, Hair, and Nails”, Marcel Dekker, New York, 2004, pp.1–23.
[2] J. Shah et al., J. Lipid Res., 36, 1945 (1995)
[3] I. Hatta et al., Thermochim. Acta, 431, 94 (2005).
[4] V. Schreiner et al., J. Inves. Dermatol., 114, 654 (2000)
[5] N. Kunizawa, I. Hatta, “SPring-8 Research Frontiers 2003”, SPring-8/JASRI, 2004, pp.158–159.
[6] 八田一郎, オレオサイエンス, 12 (1), 3 (2012).
[7] 佐藤清隆, 小林雅通, 脂質の構造とダイナミックス, 共立出版, 東京, 1992, 第3章, pp.50–98.
ⒸJASRI
(Received: October 20, 2015; Early edition: May 25, 2017; Accepted: July 18, 2017; Published: August 17, 2017)






