Volume5 No.1
SPring-8 Section A: Scientific Research Report
共鳴X線散乱を用いたタンパク質の変性・折畳みに於ける内部構造変化の解析
Analysis of Intramolecular Structural Change of Protein Unfolding-Folding Process by Using Resonant X-ray Scattering
a群馬大学大学院理工学府, b室蘭工業大学
aGraduate School of Science and Technology, Gunma Univ., bMuroran Institute of Technology
- Abstract
-
タンパク質などの生体物質の機能発現・反応は、水溶媒中で行われる。そのため、様々な溶液環境下での“その場”観測が可能なX線溶液散乱法は、大変有効な手法である。我々は、第3世代放射光光源であるSPring-8のビーム特性を生かして、空間分解能250 nmから0.3 nm程度の広範囲の散乱データを測定し、タンパク質の4・3次構造からドメイン間の相関,ドメイン内部構造,2次構造領域までの構造階層に依存した構造転移などの解析が可能であることを既に報告している。本研究は、第3世代放射光光源のビーム特性と共鳴X線散乱を活用して、タンパク質分子内の特定部位間の距離相関を選択的に抽出するための新たな手法を開発する目的で実施された。本研究の推進により、希薄なタンパク質溶液においても、定性的には観測が可能であることが分かった。定量的な解析のために、さらに統計精度をあげた実験を予定している。
キーワード: タンパク質,広角散乱,共鳴散乱
1.研究の背景
生体反応の分子機構の解明には、溶液中の機能状態でのタンパク質や生体膜の構造情報を得ることが重要である。一方、放射光X線溶液散乱法は、様々な環境条件下に於ける“その場”観測が可能なため、多くの研究に利用されているが、分子外形などの低分解能の評価に用いられることが多く、局所構造の解析には殆ど用いられていない。また、共鳴(異常)X線散乱を利用すると、特定の元素の散乱能を大きく変化させることが可能であるが、タンパク質の結晶構造解析に利用されているのみで、溶液散乱では実現していない。課題申請者は、第3世代放射光光源を用いたタンパク質や生体膜の広角X線散乱法の開発的な研究を行い、0.2 nmから250 nmまでの範囲の全階層構造領域、すなわちタンパク質の2次構造から4次構造、生体脂質のアルキル鎖のパッキングから凝集体の全体構造までの観測、溶液広角散乱データの補正・階層構造の解析方法を世界に先駆けて示した[1]。共鳴X線散乱を利用すると、溶液中でのタンパク質や生体膜、特に多くの生体反応過程において重要な役割を果たしている金属原子を内包した金属タンパク質の機能構造に関して新たな検討を行うことができると期待された。課題申請時点において、確立した溶液広角X線散乱データの補正・階層構造の解析方法により、タンパク質構造転移における階層構造間の協同性[2]、転移の同時性、水和シェルの変化[3] 、アミロイド構造転移とその過程に対する脂質混合系の影響[4]、crowding環境化におけるタンパク質の熱構造転移のアンフォールディング・リフォールディング過程におけるタンパク質の水和状態の変化と変性の中間状態の安定化[5]などの報告を行っており、そのような経緯から本研究の実施に至った。
2.研究の目的
上記の研究を基礎にして、本研究は、金属タンパク質や重原子ラベルタンパク質を用いて、それらに内在する重原子の位置情報を選択的に抽出可能な新たな共鳴(異常)X線溶液散乱法の確立を目指す目的で計画された。研究の主眼は、共鳴X線散乱法と広角X線散乱法を融合させた、新たな溶液広角X線散乱法の可能性を探索することであった。
3.実験結果と議論
硬X線共鳴散乱実験には、Feを含有するヘムタンパク質(ヘモグロビン、フェリチン)及びs-s結合を水銀に置換したHgラベルリゾチームを使用した。用いたX線吸収端は、FeはK吸収端、HgはL吸収端を利用し測定を行った。
1)実験 I:標準試料,測定試料,試料セルの吸収端近傍の吸収プロファイルの精密測定と異常分散測定波長の決定
よく知られているように、電磁波の一種であるX線は、物質を構成する原子中の電子と相互作用して散乱現象を引き起こす。その相互作用の大きさを表す原子散乱因子fは散乱角とX線のエネルギーに依存し、下式で与えられる。
![]()
右辺の第2,3項は、入射X線のエネルギーに依存する異常分散(共鳴)項で、内核電子(K核,L核など)の軌道エネルギー状態によって決まり、角度には殆ど依存しない。硬X線を利用すると、少数の金属原子を内包する金属タンパク質内部の特定部位の構造をモニターすることが可能となる(位相コントラスト)。これが本研究の目的であった。Hg及びFeの吸収端は、重原子ラベルに使用した醋酸水銀溶液及びFe薄膜をそれぞれ使用し、吸収端の文献値近傍のエネルギーを変化させて、X線吸収端を実測した。Fig.1にその結果を示す。この測定結果に基づき、入射X線エネルギー(波長)の変調範囲を決定した。図中の矢印は、タンパク質の測定において、実際に用いたエネルギーの主な点を示す。タンパク質内部の重原子では、吸収端のケミカルシフトが生じる可能性があり、測定試料そのものを利用して吸収端の決定を行うことが重要であると考えたが、試料濃度が希薄であり、実測は困難であった。
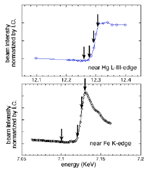
Fig.1. Hg及びFeの吸収端の決定
2)実験 II:室温状態での各タンパク質の測定(共鳴散乱)
ヘモグロビン,フェリチン,Hgラベルリゾチーム及びコントロール試料としてnativeリゾチームの測定をHgとFeの吸収端近傍で行った。Fig.2にnativeリゾチームとHgラベルリゾチームの広角X線散乱測定結果(5% w/v, 20 mM Tris, pH7.4, 20 mM NaCl, 25 °C)を示す(カメラ長289 mm)。タンパク質の2次構造領域までのデータが観測されている。両者に殆ど差が見られないが、Hgラベルリゾチームの散乱曲線をnativeリゾチームで規格化すると、両者の相違が明確に現れる(Fig.3)。Fig.3には、入射X線のエネルギーを変化させた場合の、理論散乱曲線から得られる散乱関数をnativeリゾチームの理論散乱曲線で規格化した場合を比較のため表示している。両者を比較すると、定性的なプロファイルの一致が見られる。特に、分子内部構造を反映するq=0.2-0.6 Å-1の領域のダブルピークの位置はほぼ一致している。これは、Hg置換のs-s結合部位が4箇所存在し、それらの間の距離相関に対応している。また、リゾチーム分子は2つの構造ドメインを有するが、ドメイン内のヘリックス・シートのパッキング構造及び2次構造を反映するq=0.8-1.8 Å-1の領域に関しては、理論散乱計算から予測されるようなピークやショルダーの分離が不明確であり、統計精度が明らかに不十分である。吸収端近傍の散乱関数のエネルギー依存性から、Hg原子位置のみの構造情報を抽出することが残念ながら困難であった。
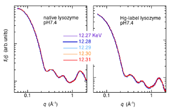
Fig.2. native lysozyme及びHg-label lysozymeの広角X線
散乱曲線のHg-LⅢ吸収端近傍の入射X線エネルギー依存性。
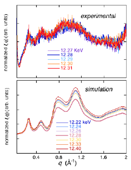
Fig.3. native lysozyme で規格化したHg-label lysozyme散乱関数
のエネルギー依存性。実験データ及び理論計算の比較。
次に、Feの吸収端近傍で入射X線のエネルギーを変化させたnativeヘモグロビン及びnativeフェリチンの散乱測定結果をFig.4に示す。溶液条件は、2.5% w/v,20 mM Tris, pH7.4, 20 mM NaCl, 25 °Cである。何れのタンパク質も分子量がリゾチームと比較して大きいため(ヘモグロビン64.5 kDa;フェリチン480 kDa)、カメラ長は289 mmと4118 mmの二通りで行い、中角領域のデータで結合している。観測した実空間領域は~2000 Å – 3 Åである。
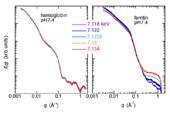
Fig.4. hemoglobin及びferritinの小角・広角X線散乱曲線
のFe-K吸収端近傍の入射X線エネルギー依存性。
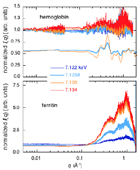
Fig.5. off-edge 7.118 keVの散乱曲線で規格化した散乱関数
のエネルギー依存性。hemoglobinに関しては、理論計算との比較を示す。
ヘモグロビンは4つのヘムを含有した四量体であるが、重原子数/全原子数の比率がリゾチームと比較して小さく、吸収端近傍のエネルギー変化に対する散乱強度変化が相対的に小さくなっている。q=0.1 Å-1以下の分子外形を反映する小角領域ではエネルギー依存性は見られない。Fig.5に示すように、q=0.02-0.06 Å-1の領域に関しては、理論散乱曲線のエネルギー依存性から想定される位置にブロードな山が観測されているが、q=0.08-1.8 Å-1の領域に関しては、相違が大きい。また、超分子構造を形成しているフェリチンの場合、q=0.1 Å-1以下の分子外形を反映する小角領域では、ヘモグロビンと比較して分子内に含まれるFeの含有率が高いため、異常分散コントラスト変化による強度変化が観測されている。q=0.2-0.6 Å-1の中•高角領域に関しても同様にエネルギー依存性が見られた。
3)実験 III:Hg ラベルリゾチームの変性状態での測定(共鳴散乱)
Hgラベルリゾチームの昇温に伴う内部構造変化(熱構造転移)を共鳴広角X線散乱測定により、観測と解析することを試みた。温度は25°Cから85°Cまで10°C毎に昇温し、near-edge及びoff-edgeでの散乱をX線エネルギーを交互に変えながら測定した(Fig.6)。広角X線散乱曲線が2次構造領域まで通常の溶液散乱パターンとしては十分な統計精度で観測できている。過去における同様の溶媒や試料条件の測定とほぼ同様の結果である[2]。散乱曲線の入射X線エネルギー依存性(共鳴散乱効果)を確認するために、Fig.5と同様に、near-edge (12.28 keV)の散乱曲線をoff-edge(12.30 keV)の散乱曲線で規格化を行った(Fig.7)。尚、溶液条件は、2% w/v, 20 mM クエン酸ナトリウム,pH5.5,pH4.5,pH2.9であった。
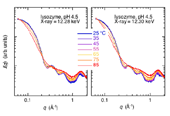
Fig.6. Hg-label lysozymeの熱構造転移の広角X線散乱曲線。
Hg-LⅢ吸収端近傍の入射X線エネルギー依存性。
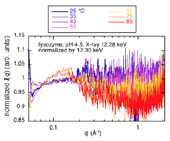
Fig.7. Fig.6のHg-LⅢ near-edge (12.28 keV)の熱構造転移
広角X線散乱曲線をoff-edge 12.30 keVの散乱曲線で規格化。
Fig.7から明らかなように、昇温に伴い分子内構造を反映するq=0.2-0.6 Å-1の領域及びドメイン内のヘリックス・シートのパッキング構造ならびに2次構造を反映するq=0.8-1.8 Å-1の領域において、入射X線エネルギー依存性が見られるが、統計精度が低く、Hgラベルされた特定部位間の距離相関のどれに相当する(Fig.3)のか、定量的な解析は現時点では困難である。
結果及び今後の課題:
今回の研究によって、共鳴X線散乱法によるタンパク質の内部構造観測が原理的には可能であることが分かった。しかし、定量的な解析・議論を行うためには、吸収端近傍の入射X線のエネルギー変化に伴う溶質分子からの散乱強度変化が小さいため、十分な統計精度のデータを取得して試料調整や解析法を含めたさらなる追試実験と検討が必要である。内部に複数の重原子を内包したHgラベルリゾチームの場合、吸収端近傍の共鳴散乱コントラスト変化による散乱パターンの変化は通常の溶液濃度(1% w/v)でも十分測定可能であることが確認できたが、これを用いた熱安定性に関しては、流動等によって放射線損傷を避けた長時間露出による統計精度の向上が必要であり、現時点では差分解析は困難であることが判明した。重原子を内包する金属タンパク質(ヘモグロビン、フェリチン)に関してはFeの含有率が低いため、やはり十分な統計精度を得る必要が有るため、濃度条件等を考慮して追試実験を計画している。
参考文献:
[1] M. Hirai et al., J. Sync.Rad., 9, 202 (2002).
[2] M. Hirai et al., Biochemistry, 43, 9036 (2004).
[3] M. Hirai et al., J. Appl. Cryst. 40, s17 (2007).
[4] M. Hirai et al., J. Appl. Cryst. 40, s184 (2007).
[5] M. Hirai et al., Thermochimica Acta, 532, 15 (2012).
ⒸJASRI
(Received: July 1, 2016; Early edition: August 25, 2016; Accepted: December 12, 2016; Published: January 31, 2017)






