Volume1 No.1
Section B : Industrial Application Report
界面活性剤処理によるヒト皮膚角層の構造変化の小角・広角X線散乱法を用いた解析
Study on the Structural Change of Human Stratum Corneum Induced by the Treatment of Surfactant Solutions Using Small- and Wide-Angle X-ray Scattering
a花王株式会社, b(公財)高輝度光科学研究センター
aKao Corporation, bJASRI
- Abstract
超純水およびドデシル硫酸ナトリウム水溶液の処理によるヒト皮膚角層の構造変化を、小角・広角X線散乱法により解析した。従来報告されている細胞間脂質層のアルキル鎖充填構造、ケラチン線維のプロトフィブリル構造のピークに加えて、我々は0.5 nm-1 < q < 3 nm-1 の領域に複数のブロードなピークを初めて検出した。この領域のピークは溶液処理により位置・強度が変化したが、これはケラチンのミクロフィブリル構造の変化を反映している可能性がある。
キーワード: human stratum corneum, surfactant, X-ray scattering, soft keratin, intercellular lipids
背景と研究目的:
皮膚洗浄剤に代表される化粧品には、種々の界面活性剤が配合されている。界面活性剤水溶液で皮膚を処理すると、角層の膨潤(溶液の多量な浸透による角層の体積増加)が起こることは良く知られている。角層に浸透した界面活性剤水溶液は、角層細胞内と細胞間隙の両方に分布するが[1,2]、角層細胞内に浸透した水溶液は、角層構成成分(主としてソフトケラチン)の構造変化や保湿成分(NMF等)の溶出により、水分保持能等の角層機能を低下させると考えられる。角層細胞内のソフトケラチンの構造変化として、これまでに透過型電子顕微鏡によるケラチンパターンの乱れの観察などが報告されているが[2]、ケラチン線維構造レベルでの解析例は少ない。そこで本研究では特にケラチン線維のフィブリル構造に着目し、界面活性剤水溶液処理に伴う構造変化を小角・広角X線散乱法によって解析した。
実験:
a) 試料:腹部角層シート(Biopredic社より購入)および踵から採取した角層粉末(健常成人のボランティアより採取)を用いた。処理溶液としては、超純水およびドデシル硫酸ナトリウム(SDS)水溶液(3 wt%,皮膚洗浄剤の実使用における濃度を想定)を用いた。
b) 実験方法:相対湿度25%のデシケータ内に36時間以上保存した角層試料を溶液セル[3]に充填し、乾燥状態における小角・広角X線散乱測定を行った。その後、処理溶液(超純水またはSDS水溶液)をセル内に注入し、注入5分後から5分毎に90分まで時分割測定を行った。さらに長時間経過後の構造変化を調べるため、溶液注入6時間後についても測定を行った。
c) 測定条件:SPring-8のBL40B2を利用して実験を行った。X線の波長は0.083 nm(15 keV)、カメラ長は500 mmとし、検出器としてはイメージングプレートを用いた。散乱像を取得後、円環平均を計算し、1次元散乱プロファイルデータを得た。
結果および考察:
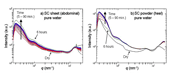
図1に、二種類の角層試料の乾燥状態(溶液処理前)の散乱プロファイルを示す。腹部シートの角層(図1a)では、散乱ベクトルq ≈ 15 nm-1,17 nm-1にシャープなピークが観測されており、これは細胞間脂質のアルキル鎖充填構造(前者が斜方晶と六方晶の重なり、後者が斜方晶に由来)を示すものである[4]。また、q = 6 nm-1近傍に見られるブロードなピークは、ケラチンタンパク質のプロトフィブリル構造によるものと考えられている[5]。q ≈ 1.2 nm-1近傍にブロードなピークが見られるが、後に詳述するがこのピークの帰属は明らかでない。踵角層粉末の散乱プロファイル(図1b)の腹部シートと比較した最も大きな相違は、前者ではq ≈ 15 nm-1,17 nm-1の細胞間脂質のアルキル鎖充填構造のピークが観測されないことである。これは、踵角層部には細胞間脂質が極めて少ないことを考えれば妥当である[6]。q = 6 nm-1近傍のケラチンのプロトフィブリル由来のブロードなピークは、腹部角層と比較してより明瞭に観測された。また、q = 1.3 nm-1近傍にやはりブロードなピークが見られたが、そのピーク形状は腹部シートの場合とは異なるように見え、この領域に複数のブロードピークが重なっている可能性を示した。
図1. 二種類の角層試料の乾燥状態におけるX線散乱プロファイル。a)腹部角層シート、b)踵角層粉末。
腹部角層シート、踵角層粉末の二種類の試料を超純水で処理したときの小角・広角X線散乱プロファイルを図2に示す。腹部シート(図2a)について、q = 20 nm-1近傍の強度が経時的に増加しているのは、水が角層内に浸入したことを示している(水の散乱プロファイルはq = 20 nm-1近傍にブロードなピークを有することがわかっている)。q = 15 nm-1,17 nm-1近傍の細胞間脂質のアルキル鎖充填構造のピークには、超純水処理による顕著な変化は見られなかった。一方、q = 6 nm-1近傍のケラチンのプロトフィブリル構造のピークは、経時的に低q側にシフトしながらよりブロード化し不明瞭になった。これは角層細胞への水の浸入により、プロトフィブリルがその配向性を乱しながら膨潤したためと推定される。また、0.7 nm-1 < q < 2 nm-1の領域に複数のブロードなピークが検出された。超純水処理後のプロファイルと初期(乾燥状態)のプロファイルの差分を取り、経時的なプロファイル変化を詳細に解析した結果、この領域に少なくともq = 1 nm-1(実空間での構造サイズ約6 nmに対応)、q = 1.6 nm-1(構造サイズ約4 nm)の2本のブロードなピークがあり、その強度が超純水処理後に経時的に増加することがわかった。踵角層粉末(図2b)においては、超純水処理によるプロファイル変化は腹部シートよりも速やかに起こり、処理後5分までの間にプロファイル変化が生じ、極小角領域を除き5分後以降はほとんど変化が無かった。変化の傾向は腹部シートの場合とほぼ同様であり、プロトフィブリルのq = 6 nm-1近傍ピークの低q側へのシフトと強度減少、およびq ≈ 1 nm-1、q ≈ 1.8 nm-1にブロードなピークが観測された。
図2. 角層を超純水で処理したときのX線散乱プロファイルの経時変化。 a)腹部角層シート、b)踵角層粉末。
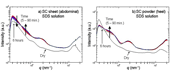
二種類の角層をSDS水溶液で処理したときのX線散乱プロファイルを図3に示す。腹部角層シートの結果(図3a)について見ると、散乱プロファイルは処理後5分以内に大きく変化した。水の角層への浸入を示すq = 20 nm-1近傍の強度が処理後5分以降変化しなかったことから、SDS水溶液の角層への浸透が超純水よりも速いことがわかった。q = 15 nm-1,17 nm-1近傍の細胞間脂質由来のピークには、顕著な経時変化は見られなかった。q = 6 nm-1近傍のケラチンプロトフィブリルのピークはSDS処理後にほぼ消失した。0.5 nm-1 < q < 3 nm-1の領域のプロファイルの経時変化は超純水処理の場合よりも顕著であり、q = 0.6 ∼ 0.7 nm-1(構造サイズ約9 ∼ 10 nm)近傍、およびq = 1.8 ∼ 2nm-1(構造サイズ約3 ∼ 3.5 nm)近傍にブロードなピークが見られた。踵角層粉末のSDS水溶液処理によるプロファイル変化(図3b)は、腹部シートの場合と同様の傾向を示した(q = 1.8 ∼ 2 nm-1の領域のブロードピークの位置は異なる)。
図3. 角層をSDS水溶液で処理したときのX線散乱プロファイルの経時変化。 a)腹部角層シート、b)踵角層粉末。
今回の角層の溶液処理実験においてX線散乱プロファイルの変化が最も顕著だったのは0.5 nm-1 < q < 3 nm-1の領域であるが、この領域のブロードなピークについてはその帰属に関する議論が少ない。このqの範囲に検出される可能性のある角層構造として、細胞間脂質のラメラ長周期構造(約6 nm)が考えられる。超純水処理時に見られたq = 1 nm-1のピークは、対応する構造サイズを考えるとこれに近いが、これを細胞間脂質の短周期構造と水の浸入によるその膨潤と考えるには、以下の2点の疑問が残る。
1) 踵部は腹部と比較して細胞間脂質量が顕著に少なく[6]、実際,踵角層サンプルからはq = 15 nm-1,17 nm-1近傍の脂質アルキル鎖充填構造のピークが検出されていない(図1b,2b,3b)。このとき、短周期ラメラ構造由来のピークのみが検出されるとは考えにくいこと。
2) SDS処理後にはq = 0.6 ∼ 0.7 nm-1(構造サイズ約9 ∼ 10 nm)にピークが検出されている。これをラメラ層間への水の浸入による膨潤(q = 1 nm-1のピークがシフトしたもの)と考えるには、層間隔の増加が大きすぎること。
また、0.5 nm-1 < q < 3 nm-1の領域には超純水またはSDS水溶液の処理によりq ≈ 1.6 ∼ 2.0 nm-1の範囲にブロードなピークが見られており、これは構造サイズとしては3 〜 4 nmに対応するが、細胞間脂質ラメラ層には対応する構造サイズが無い。以上のことから我々は、この領域のピークがケラチン線維の高次構造を反映したものではないかと考えている。皮膚のケラチンは、直径約2 nmのプロトフィブリルが10本程度集合したミクロフィブリル構造(直径約7 nm)を有していると言われている[5]。このケラチン線維高次構造を円柱形と仮定して、粒子散乱のピーク位置を求めると、その1次ピークはプロトフィブリルに対してq ≈ 5 nm-1、ミクロフィブリルに対してq ≈ 1.4 nm-1と見積もられる。すなわち、上述のq ≈ 1.6 ∼ 2.0 nm-1のピークをミクロフィブリルの半径およびそれが剤処理によって変化したものと考えれば、上述のピーク変化を解釈可能なように思われる。(q = 6 nm-1のケラチンのプロトフィブリルのピークを上記の粒子散乱ピークと考えると、フィブリル半径は約0.8 nmと見積もられる。)超純水処理と比較してSDS処理の場合に処理前と比較したプロファイル変化が大きいことから、SDSの高いタンパク変性能によってミクロフィブリルの構造変化(例えば直径の収縮)が生じたと考えれば、今回の結果を説明可能と思われる。
今後の課題:
今回の実験で、角層のX線散乱プロファイルを乾燥状態と溶液処理後で比較すること、異なる二種類の角層試料(腹部シートと踵粉末)間で比較することにより、主として0.5 nm-1 < q < 3 nm-1の領域に現れるブロードな散乱ピークがソフトケラチン線維の高次構造を反映している可能性を見出した。しかし、この解釈の妥当性を検証するためには以下の検討を追加する必要がある。
1) 今回の実験では、剤処理5分後から5分毎の時分割測定によって角層構造変化の追跡を試みたが、界面活性剤処理系では大部分の角層構造変化が処理後5分以内に生じていた。今後、より短い時間スケールでの時分割測定を行うことが必要である。
2) 0.5 nm-1 < q < 3 nm-1のブロードピークは、細胞間脂質含有量の少ない(アルキル鎖充填構造に対応するq = 15 nm-1,17 nm-1近傍のピークが見られない)踵角層試料でも観測されていることから、細胞間脂質の構造由来では無いと考えているが、それを更に強固に検証するために、溶剤処理などによって脂質を除去した角層シートにおける挙動を確認する。
3) 界面活性剤水溶液の散乱プロファイルを測定し、今回得られた結果と比較する。
4) タンパク変性剤など、ケラチンタンパク質の構造を大きく変化させる剤を処理した場合のX線散乱プロファイルとの比較を行う。
今後このような実験を追加することにより、今回の実験で見出された0.5 nm-1 < q < 3 nm-1の領域での散乱プロファイルの複雑な変化の詳細を解明していく。これにより、界面活性剤処理による角層機能低下に対するソフトケラチン構造の影響について、新しい知見が得られることが期待される。
参考文献:
[1] R.R. Warner, Y.L. Boissy, N.A. Lilly, M.J. Spears, K. McKillop, J.L. Marshall, K.J. Stone, J. Invest.Dermatol. 113, 960 (1999).
[2] R.R. Warner, K.J. Stone, Y.L. Boissy, J. Invest. Dermatol. 120, 275 (2003).
[3] I. Hatta, H. Nakazawa, Y. Obata, N. Ohta, K. Inoue, N. Yagi, Chem. Phys. Lipids 163, 381 (2010).
[4] J. Bouwstra, M. Ponec, Biochim. Biophys. Acta 1758, 2080 (2006).
[5] M.J. Hey, D.J. Taylor, W. Derbyshire, Biochim. Biophys. Acta 540, 518 (1978).
[6] G. Grubauer, K.R. Feingold, R.M. Harris, P.M. Elias, J. Lipid Res. 30, 89 (1989).
©JASRI
(Received: February 28, 2012; Accepted: June 20, 2012; Published: February 28, 2013)