Volume4 No.2
SPring-8 Section A: Scientific Research Report
溶液試料における軟X線照射中の安定化対策
Stable Encapsulation Method during Soft X-ray Irradiation for Hydrated Samples
a東北大学多元物質科学研究所, b量子科学技術研究開発機構関西光科学研究所
aInstitute of Multidisciplinary Research for Advanced Materials, Tohoku University,
bKansai Photon Science Institute, National Institutes for Quantum and Radiological Science and Technology
- Abstract
-
水の窓波長域は含水生物細胞を観測するのに最適な波長域と考えられているが、含水生物細胞を撮像するためには試料セル中に封入される必要がある。培養液中の細胞核試料のSX像を得るための試料セルとしてSiN薄膜を利用してきたが、強いSX光を利用した場合には安定に封入できないのが課題であった。本研究ではBL27SUを用いて不安定な条件を再現し、それをSiN薄膜にUVオゾン洗浄処理を行うことで安定に溶液試料を封入する方法を見出した。
キーワード: 軟X線顕微鏡、水の窓、含水生物細胞
1 背景と研究目的:
軟X線は波長が可視光より1桁以上短く、この波長の短さを利用する軟X線顕微鏡は可視光学顕微鏡より1桁以上高い空間分解能を持つ。また炭素と酸素のK吸収端の間の波長域は、生物細胞を構成する主要な要素である水を透過し炭素原子および窒素原子により吸収されるため、生物細胞を観察するのに最適な波長域と考えられている(水の窓)[1]。しかしこれまでの知見が少ないため、軟X線顕微鏡を用いて観察されたオルガネラ(細胞小器官)の同定が困難である。この解決のために、生物細胞内のオルガネラ構造の炭素のK吸収端や窒素のK吸収端近傍の吸収スペクトルが利用できれば、細胞内のオルガネラ構造を明らかにすることができると期待される。
以上から、我々は可視像と軟X線像の比較がし易く、かつ波長を変えた測定が容易な軟X線顕微鏡として、シンチレーターを用いた密着型の軟X線顕微鏡を開発した[2]。開発した顕微鏡の評価の一環として、SPring-8 BL27SUに開発した軟X線顕微鏡を持ち込み、溶液中の生物細胞試料の観察と吸収スペクトルの取得を試みたところ、測定中に溶液内に泡が発生し、それが移動することで安定に撮像できないという問題が発生した。本報告では試料セル中に発生した泡の移動原因の解明と解決法について報告する。
2 試料セル中の泡移動:
溶液中に泡が混入した際に試料セル中で泡が動く原因として、(1) 重力による落下、(2) 温度上昇による膨張・蒸発、(3) 試料セルから溶液のリーク、(4) なんらかの刺激が溶液に加わった際のSiN薄膜またはシンチレーターの撥水性に伴う泡の移動、の4つを原因として考えた。このうち、重力による落下は、溶液試料を試料セルに封入する際に試料方向を色々と変えて溶液の移動がないかどうかを確認していることから、原因として考えにくい。
次に、温度上昇による溶液の膨張・蒸発の可能性を考えるために、試料セル中の溶液に対する流入熱量と排出熱量を考え、熱平衡状態における溶液の温度上昇を概算した。BL27SUにおいて測定範囲内の光エネルギーとして540 eVの軟X線が試料に照射されているとするとき、流入する熱量は、軟X線がすべて熱に変わったと考えて約26 µWである。流入した熱は、試料セルが真空中に置かれていることから、ゴニオメーターを伝わり最終的には大気中に放出される。試料セルからゴニオメーター大気部分までの熱伝導量、ゴニオメーター大気側における対流伝熱量およびゴニオメーター全体からの放射伝熱量を見積もったところ、ゴニオメーター中の熱伝導量が最も小さい部位が律速となってゴニオメーター全体の排出熱量が定まり、その値は908.8 µW/°Cと見積もることができた。従って排出熱量が流入熱量に対して1桁以上高い値が得られたため、熱平衡状態においては試料セル中の溶液が気化するような温度上昇は起こりにくいと考えられる。
以上から、(3)と(4)の試料セルからの溶液のリークまたはSiN薄膜またはシンチレーターの撥水性に伴う泡の移動のどちらかが原因で、溶液中の泡が移動する可能性が高いと考えた。
残った2つの溶液の移動原因を特定するために、試料セルから溶液のリークの有無の確認と、軟X線顕微鏡による空気泡の移動の観察を行った。
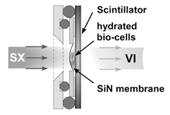
用いた溶液試料用の試料セルの構造を図1に示す。試料セルはSiN薄膜とシンチレーターを接着剤で貼ったSUS板をOリングで密閉し、溶液を外に逃がさない構造となっている。このとき、レジスト剤を用いてSiN上にパターンを描き、SiN薄膜とシンチレーター間の距離が5 µmに保たれるようにした。
図1 溶液試料用セルの概略構造。
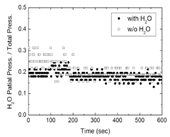
試料セルから溶液のリークの有無を確かめるために、水を入れた試料セルを真空槽内に置いて、真空槽内の水分子の分圧の変化を測定した。測定は真空槽内に四重極質量分析計(CANON-ANELVA社製, M-101QA-TDM)を取り付け、試料セルを入れる前の水の分圧と試料セルを入れた後の水の分圧の時間変化を測定した。真空槽内の圧力は、試料ホルダーを入れる前が2.3⋅10−6 Paで、入れた後が4.4⋅10−6 Paであった。また測定後に試料ホルダー内に封入した水が残留していることを目視で確認した。測定した水分子の分圧の変化を、全圧に対する分圧の割合としてプロットしたグラフを図2に示す。横軸は、試料ホルダーの導入直後を開始時刻として経過した時間を示す。グラフから、導入直後の圧力の安定しない時間帯を除くと、試料ホルダーの有無による水分子の相対分圧の変化は、ほぼ測定のバラつきの範囲内に収まった。以上から、真空槽に試料ホルダーを導入した前後の圧力の変化は、新たに導入した試料ホルダー外側からの放出ガスによるものと考えられる。
図2 水を封入した場合と封入しなかった場合における試料セルからの相対水分圧の時間変化[2]。
次に、試料中の空気泡の移動を観測した。用いた試料は、HeLa細胞から単離した細胞核を培養液中に分散させた溶液試料で、溶液試料を試料セル内に封入する際に通常は泡が入らないように試料セルを調節するが、今回は一部に空気を残し空気泡とした。
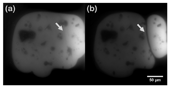
軟X線像の撮像は、SPring-8 BL27SUにおいて行った。溶液試料を封入した試料セルを真空槽に設置し、軟X線像を得るために真空に引いた。光学顕微鏡により大雑把な位置合わせを行った後、軟X線を照射して軟X線像を得るために精密な焦点合わせを行った。像は265 eVの光エネルギーを用いて露光時間35秒、30秒間隔で連続して得た。得られた結果を図3に示す。像は透過像で、溶液部分を強調するために水の部分が黒くなるように最小値を調整した。最大値は光強度の最大値とした。図中、矢印で示した部分で溶液が動いていることが分かる。以上から、リークがなくても封入された空気泡が移動したことから、光刺激とSiN薄膜の撥水性により空気泡が移動すると考えた。
図3 溶液試料の透過軟X線像。光強度をグレースケールで表した。図中、黒い部分が水。光強度が2次元分布を持つため、右側の方が光強度は強い。細胞核は黒い水の中に含まれているがコントラストの関係で見えにくい。(a)を撮像後約1分後に(b)を撮像。光刺激により矢印部分で水が移動している。
3 SiN薄膜の親水化処理とその結果:
SiNが持つSi-N基は親水性を示すため、SiN膜は本来、親水性を示すはずである。SiN膜はシラン(SiH4)やアンモニア(NH3)を原料とするCVD法により作製されることが多く、製膜の過程でSiN膜表面にはSi-C結合、C-C基などを持つ炭化物層が付着する。この炭化物はSiN膜が疎水性を示す原因となる[3]。特に本研究で用いたSiN薄膜はフォトレジストによるスペーサー加工を施しているため、2節の実験結果からフォトレジストに伴う炭化物層が付着しているものと考えられる。
SiN膜に親水性を持たせるには2つの方法がある。ひとつは用いる溶液に界面活性剤を混ぜて撥水性を下げる方法で、もうひとつはUVオゾン洗浄法によりSiN膜表面の炭化物を取り去り、SiN膜自体が持つ親水性を利用する方法である。含水生物試料を封入する際に界面活性剤を用いると生物試料自体を洗い流してしまうため、界面活性剤は親水化処理として利用できない。従ってUVオゾン洗浄法により親水化処理を試みることにした。
親水化処理は以下のように行った。15⋅15 mmのSiウェハー上に製膜した200 nm厚のSiN薄膜をUV洗浄装置(あすみ技研社製, ASM1101N)を用いて、UVオゾン洗浄を20分間行った。洗浄前と洗浄後に蒸留水をSiN薄膜上に着液し、薄膜の濡れ性を評価した。
SiN薄膜状の濡れ性を評価した結果を図4に示す。図4(a)はUVオゾン洗浄前で、蒸留水がSiN薄膜上で玉状に弾かれているのが分かる。一方で、UVオゾン洗浄後では蒸留水はSiN薄膜を一様に濡らす様子が観察された(図4(b))。蒸留水の接触角を計測したところ、UVオゾン洗浄前の接触角は46.5°、洗浄後の接触角は3°との結果を得た。以上からSiN薄膜の濡れ性は、UVオゾン洗浄により改善できることが明らかとなった。
図4 UVオゾン洗浄の有無によるSiN薄膜上の水滴の濡れ性の比較。(a) UVオゾン洗浄前。(b) UVオゾン洗浄後。濡れ性が改善し水がSiN薄膜全面に拡がっている。黒線はスケールバーで長さは5 mmに相当する。
最後に濡れ性の改善により溶液中の細胞試料が安定に計測できることを確かめた。試料はSiN薄膜上に培養した細胞を、UVオゾン処理をしたSiN薄膜により覆った。3節と同様、SiN薄膜で覆う際には空気泡を人為的に取り込んだ。
軟X線照射実験はUVSOR BL4Uにおいて行った。Fresnel Zone Plateにより50 nm程度に絞った軟X線を照射し、そのときの光子数をおおよそ109 photons/secと見積もった[4]。この値は単位面積当たりに換算すると、2節で示したSPring-8 BL27SUにおける単位面積当たりの光子数に比べて約3桁大きい。この条件下で試料を掃引し軟X線顕微鏡像計測を17時間ほど行った後、空気中に取り出して空気泡の状態を観測した。
図5にその結果を示す。四隅に5 µm厚のスペーサー層が観測され、中心部にはSiN薄膜とシンチレーターによる干渉縞が観測される。図中矢印で示すように、画面右側に空気泡が存在し、これは測定前後で移動することはなかった。
図5 UVオゾン洗浄処理したSiN薄膜で封入した後、軟X線顕微計測後の溶液試料中の泡(矢印)。一方で、封入に用いた薄膜間の厚さが小さいため中心部に干渉縞が見えている。また図中に見える白い筋や点は封入した細胞による構造。
4 まとめ:
SiN薄膜により溶液試料を封入して測定する際に軟X線測定が安定に行えない原因が、光刺激とSiN薄膜表面の撥水性に起因すると考えられることを示した。またUVオゾン洗浄を行ったSiN薄膜を用いて含水生物細胞の封入を行い、約17時間の軟X線像の撮像実験が行えたことを示した。このことから、UVオゾン洗浄によるSiN薄膜の親水化処理が含水生物細胞撮像に有効な手法であると考えられる。この手法は、含水生物細胞に限らず、広く溶液試料に有効な手法と考えられる。
5 謝辞:
本研究を行うに当たって以下の先生方にお世話になりました。記して感謝の意といたします。奈良女子大学の青山雅人博士、安田恵子准教授、保智己教授、川崎医科大学の刀祢重信准教授に試料を提供して頂きました。また分子科学研究所の大東琢治博士にはSiN薄膜の親水化処理の際に機材一式を提供して頂きました。なお本研究の一部は、科研費(23241038, 25600136)の助成を得て行いました。
参考文献:
[1] D. Sayre, J. Kirz, R. Feder, D. M. Kim and E. Spiller, Science 196, 1339–1340 (1977).
[2] T. Ejima, Y. Neichi, F. Ishida and M. Yanagihara, J. Phys.: Conf. Ser. 463, 012055 (2013).
[3] T. Yara, T. Takeuchi, 特開2009-4153 (日本国特許庁公開特許公報 8, Jan., 2009)
[4] 光源からのphoton fluxと光学系に基づく概算。T. Ohigashi, H. Arai, T. Araki, N. Kondo, E. Shigemasa, A. Ito, N. Kosugi and M. Katoh, J. Phys.: Conf. 463, 012006 (2013).
ⒸJASRI
(Received: February 19, 2016; Early edition: April 25, 2016; Accepted: June 24, 2016; Published: July 25, 2016)