Volume4 No.1
SPring-8 Section A: Scientific Research Report
超高速時分割X線回折像記録による昆虫飛翔筋力学感受性成分の種間普遍性に関する研究
Study on the Cross-taxonal Distribution of Mechanosensitive Components in Insect Flight Muscle by Ultrafast Time-resolved X-ray Diffraction Recordings
(公財)高輝度光科学研究センター
JASRI, SPring-8
- Abstract
-
カルシウムイオンにより活性化したタガメおよびミカドガガンボの飛翔筋線維を急速にステップ伸長(振幅:筋線維長の1%;伸長時間:1 ms)したときの2次元X線回折像の時間変化を0.5 msの時間分解能で記録した。その結果、これらの昆虫の飛翔筋線維で伸長時に起こる構造変化は、すでに判明しているマルハナバチ飛翔筋線維の構造変化と基本的に同じであることが判明した。
キーワード: 高速時分割X線回折実験、昆虫飛翔筋、生物物理学
背景と研究目的:
筋肉の収縮は、筋細胞内カルシウム(Ca)濃度の上昇によって開始される。Caイオンが収縮調節蛋白トロポニンに結合すると、アクチン繊維上でミオシンの結合を阻害していたもう1つの収縮調節蛋白トロポミオシンが移動し、アクチンとミオシンが相互作用を開始して張力発生が起こる。
一部の進化した昆虫の羽ばたき周波数が500 Hz-1000 Hzにも及ぶものがある。これらの昆虫では飛翔筋(羽を動かす筋肉)の収縮弛緩の制御を通常の方法(細胞内Ca濃度を上下させる)で行うのは不可能である。そこで、これらの昆虫では低いインパルス頻度で細胞内Ca濃度を一定に保ち、飛翔筋が自励振動を行うことで高い羽ばたき周波数を可能にしている(非同期型動作)。この非同期型動作に不可欠なのがいわゆるStretch activation(伸張による活性化)である。Stretch activationの分子機構はいまだに解明されていない。
筆者のグループはこれまでに、浜松ホトニクス製高速CCDカメラ(C7770)を用い、マルハナバチとタガメの飛翔筋線維をステップ伸長したときの2次元X線回折像変化を3.4 msの時間分解能で記録し解析した[1]。しかしこのCCDカメラは画像サイズが640×480ピクセルと小さく、また順番に使われる3個のCCD素子間の特性のばらつきにより、精密な解析は困難であった。その後、より高速で画像サイズの大きなCMOS型高速カメラ(フォトロン製SA5、1024×1024ピクセル)が利用可能になったため、これを利用して改めてマルハナバチ飛翔筋線維のステップ伸長時の回折像変化を0.5 msの時間分解能で測定した[2]。その結果、各種反射の強度変化の時定数を精密に決定し、張力変化と比較できるようになったほか、d=38 nmの層線反射の中に伸長に敏感に反応する反射スポット(111,201)が存在することが明らかになった[2]。この反射スポットは伸長に対して最も早く反応するため、これがStretch activationの引き金になる構造変化を反映する可能性がある。これが事実であるなら、Stretch activationを示す非同期型飛翔筋をもつ昆虫なら、全て同様な反射強度変化が観察されると期待される。そこで、材料としてタガメとミカドガガンボの飛翔筋線維を用い、これらが伸長時にマルハナバチの飛翔筋線維と同様な反射強度変化を示すかどうかをCMOS型高速カメラにより調べた。
実験:
材料:タガメ(Lethocerus deyrollei)は、本種を飼育する知人より譲り受けたものであり、ミカドガガンボ(Ctenacroscelis mikado)は SPring-8構内で捕獲したものである。これらの飛翔筋を既に記載した方法[1,3]でグリセリン処理し、単離した筋線維を試料セルにマウントして用いた。実験に用いた溶液も以前記載したとおりである[1,3]。
測定:測定はBL40XUビームラインで行った。X線エネルギーは12.4 keV、カメラ長は2.3 mでX線フラックスは1015 photons/sであった。測定法は、検出器にSA5を用いた以外は基本的に[1]に記載したとおりである。遠隔操作により、筋線維をマウントした試料セルにCaイオンを含んだ活性化液を送り、筋線維を活性化した。その後、照射損傷を軽減するため試料セルを筋線維軸方向に100 mm/sの速度で移動させながらX線回折像を測定した。露光中にサーボモーターにより、筋線維長の1%のステップ伸長(1 msで完了)を加えた。また、対照として弛緩液中に置いたまま伸長した筋線維のX線回折像も記録した。検出器は前述のとおりSA5をイメージインテンシファイヤ(VP5445-MOD、浜松ホトニクス製)と組み合わせて用い、時間分解能は0.5 msである。
結果および考察:
本実験の主要な目的は、伸長に敏感に反応する反射スポット(111,201)がタガメやミカドガガンボにおいてもマルハナバチと同様な挙動を示すかどうかを確認することであったが、これの結果については近いうち学術雑誌に投稿予定であるので、ここではこれ以外に同時に測定される反射のうち、トロポニン由来の3つの反射(101,102,003)について記載する。昆虫飛翔筋のトロポニンはアクチンフィラメント上に38.7 nmの周期で存在している。隣り合った2つのトロポニンの中間の位置でアクチンモノマーがミオシンと結合しやすい向きになっているため(ターゲットゾーンと呼ばれる)、ここにミオシン頭部が選択的に結合するのだが、このときトロポニンとの干渉のため奇数次の反射(101,003)の強度が減少し、偶数次の反射(102)の強度が増強する。このことは既にマルハナバチ飛翔筋で確かめられており[1,2]、101,003の減少および102の増強は伸長後の張力発生とほぼ同じ、20℃で約120 s-1の速度定数で起こることが観察されている。また実際に羽ばたいているマルハナバチ飛翔筋でも(この場合は正弦波的な長さ変化であるが)、これらの反射の強度に同様の変化が起きることが観察されている[4]。
本課題で測定されたステップ伸長後のトロポニン由来の3つの反射の強度変化の時間経過を、タガメについては図1、ミカドガガンボについては図2に示す。タガメの場合、101(黒)と 003(青)の挙動は類似しており、伸長後一過的に強度が増強した後、ゆっくりと減少している。伸長直後の小さな強度減少は他の種類では観察されておらず、原因は不明である。一方、102反射は伸長後わずかに強度が減少したあと、徐々に強度が増大している。これらは、等尺性収縮状態ですでにターゲットゾーンに結合していたミオシンが伸長によって外れた後、ミオシン結合のキネティクスに従って徐々に再結合していくところを反映するものと考えられる。この強度変化は3.4 msの時間分解能でも観察されていたが[1]、今回はより高い時間分解能とS/N比で測定することができた。
一方、ミカドガガンボの場合も101と102についてはタガメと同様であり、ミオシンが伸長によって一過的に外れた後、指数関数的な時間経過で再結合していく様子が観察されたものと考えられる。003反射の変化ははっきりしない。ミカドガガンボの回折像中には、他の昆虫の飛翔筋には観察されないd=25.8 nmの子午線反射があり、これがトロポニン(アクチンらせん)の基本周期の倍77.4 nmの3次反射と解釈できるためアクチン繊維由来と考えられるのだが、これを生じている未同定の構造と干渉が起こるために003反射の挙動がタガメと異なる可能性がある。
以上の結果は、細部においては種間の差異があるものの、タガメやミカドガガンボの飛翔筋の伸長時に起こる収縮蛋白の構造変化はマルハナバチの場合と基本的に同じであることを示す。
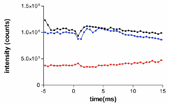
図1.タガメ飛翔筋のトロポニン由来反射の強度の時間変化。黒が101、赤が102、青が003反射を示す。伸長は時間0のところで与えられている。縦軸はアナログ→デジタル変換後のカウント(検出器は12ビット深度)。約20個の試料からのデータを加算したもの。
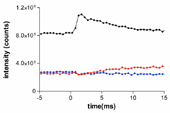
図2.ミカドガガンボ飛翔筋のトロポニン由来反射の強度の時間変化。表示は図1と同様。8個の試料からのデータを加算したもの。
今後の課題:
この実験において、タガメとミカドガガンボの飛翔筋線維のステップ伸長に伴う反射強度変化は、すでに観察しているマルハナバチのものと基本的に同じであることが分かった。今後はこれらの強度変化を最もよく説明できるモデルを構築することが課題である。
参考文献:
[1] Iwamoto, H., Inoue, K. and Yagi, N. Fast X-ray recordings reveal dynamic action of contractile and regulatory proteins in stretch-activated insect flight muscle. Biophys. J., 99: 184-192 (2010).
[2] Iwamoto, H. and Yagi, N. Sub-millisecond time-resolved 2-dimensional X-Ray diffraction recording from stretch-activated flight muscle from bumblebee. Biophys. J., 100: 11a-12a (2011).
[3] Iwamoto, H. Evidence for unique structural change of the thin filaments upon calcium-activation of insect flight muscle. J. Mol. Biol., 390: 99-111 (2009).
[4] Iwamoto, H. and Yagi, N. The molecular trigger for high-speed wing beats in a bee. Science, 341: 1243-1246 (2013).
ⒸJASRI
(Received: June 5, 2015; Early edition: August 25, 2015; Accepted: December 11, 2015; Published: January 25, 2016)






