Volume4 No.1
SPring-8 Section C: Technical Report
マイクロビームX線回折トモグラフィーの試み(2015)
Microbeam X-ray Diffraction Tomography at BL40XU(2015)
(公財)高輝度光科学研究センター 利用研究促進部門・バイオソフトマテリアルグループ
Bio-and- Soft-materials Group, Research & Utilization Division, JASRI
- Abstract
-
BL40XUにおいて、直径約5 µmのX線ビームを用いて回折トモグラフィー実験を行った。試料としてはヒト毛髪を使用した。試料は垂直に置き、水平位置を5 µmずつ変えながら、各位置で試料を回転して9度ごとに回折パターンを記録し、回折強度を定量することにより、毛髪の断面におけるケラチンと脂質の分布を可視化することが可能であった。本手法においては、試料の放射線損傷の回避が最大の課題である。
キーワード: X線回折トモグラフィー、毛髪、ケラチン、脂質
背景と研究目的:
X線回折トモグラフィーは、異なった成分を持つ複数の領域から構成される試料において、透過X線の生じる散乱・回折の強度がX線ビーム上における成分の量に比例することを利用して、試料断面におけるそれら領域のマッピングを行う手法である。古くはフォトンファクトリーのオーストラリアビームラインにおいて、Morganらによって技術開発が行われた[1]。この場合には、試料中の各領域は微結晶の集合体であり、粉末回折パターンを記録して、それぞれの領域からの反射ピークの強度を定量し、CT(computed tomography)のアルゴリズムで再構成を行って断面像を得ている。その後ESRFのSpanneらは、脂肪、骨と筋肉から成る試料を用いて、広角X線散乱の強度を定量することにより、これらを分離して断面でマッピングできることを示した[2]。最近ではSwiss Light Sourceにおいて、脳内のミエリン(神経軸索を取り囲むリン脂質の層)の分布を、脂質のラメラ反射の強度を用いて可視化する研究が行われている[3]。
X線回折トモグラフィー実験では、試料をX線ビームに対して垂直に並進移動させ、各位置で試料を回転して複数の角度で回折パターンを得るのが普通である(これはいわゆる第一世代CTと同じ方法である)。したがって、その空間分解能は主として用いるX線ビームの太さで決まる。そこで本実験ではX線マイクロビームを用いてX線回折トモグラフィーを行い、高分解能のマッピングを試みた。試料としては、ヒト毛髪を用いた。
実験:
実験はBL40XUで行った(図1)。X線エネルギーは15.0 keV(アンジュレータギャップ20.1 mm)、試料から検出器までの距離は約1.5 mとした。ピンホールは直径5 µm、ガードピンホールは直径200 µmを使用した[4]。露光時間調整のために、アルミアブソーバーで強度を約7%に落とした。X線ビームと直角方向の水平自動並進ステージの上に自動回転ステージを置き、試料の健常成人男性毛髪はそのほぼ中心に立てて固定した。X線検出器は、浜松ホトニクス社製4インチX線イメージインテンシファイアと、同社の冷却CCDカメラC4742-98-24Aの組み合わせである。露光時間は1秒であった。
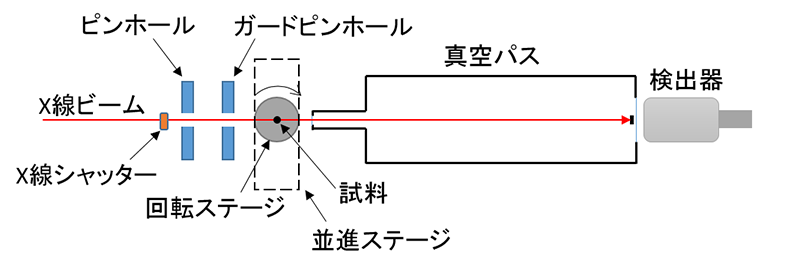
図1.実験概念図(上から見た図)
よく知られているように、ヒト毛髪の太さは50-100 µm程度であり、その表面には約10 µmの厚さのキューティクル(毛小皮)がある(図2)。これは平たい細胞が重なってできており、その内部はケラチンというタンパク質で満たされているが、このケラチンは規則的な構造を持っていない。そのためキューティクルからはケラチン由来の回折は観察されない。毛髪のキューティクルの内側は、ケラチン線維が毛髪軸に平行に並んだコルテックス(毛皮質)と呼ばれる部分から成る。コルテックス内部の毛髪中心近くにはメデュラ(毛髄質)と呼ばれる空隙があることが知られている。毛髪を水平方向(繊維軸と直角方向)に動かしつつ10 µm以下のX線マイクロビームで回折パターンを記録すると、キューティクルでは細胞間のcell-membrane-complex(CMC)と呼ばれる脂質層からの回折が得られる[4]。これはほぼ赤道方向(繊維軸と直角方向)に非常に良く配向した強い回折である(図3a)。X線ビームがコルテックスへ移動すると、キューティクルからの回折はX線ビームが細胞間脂質層をほぼ垂直に近い角度で透過するために弱くなる。その代わりに配向したケラチン繊維からの繊維回折が観察される(図3b)。この回折パターンは、赤道方向にはq=0.7 nm-1 (d=9.0 nm)付近に幅広いピークを示す。さらにX線ビームが毛髪の中央を通るようになると、q=1.5 nm-1 (d=4.3 nm)付近に、多くの場合赤道方向にやや配向した鋭い円弧状、または円環状の反射が観察され、これはメデュラを満たしている脂質からの回折と考えられる(図3c)。この回折ピークはキューティクル付近からも観察されることが多い。
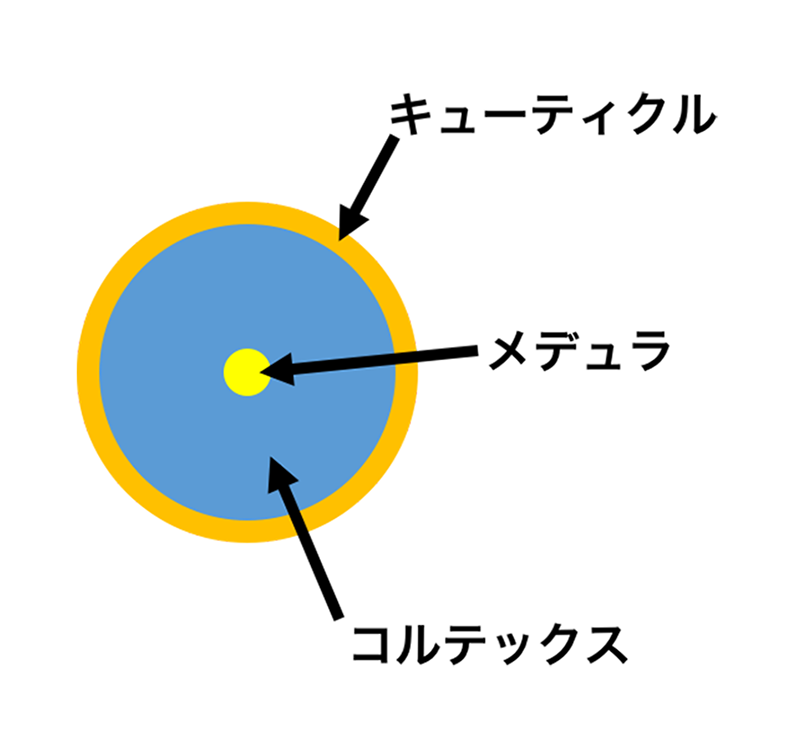
図2. 毛髪断面の模式図
実験では試料の毛髪を回転ステージに垂直に固定し、5 µmステップで水平に動かし、各点で9度ずつ回転して、各位置と角度で回折パターンを記録した。各水平位置で180度に渡って記録を行った。毛髪の全幅をカバーするために水平方向に200 µmの範囲を記録したので、撮影枚数は(200/5)*(180/9)=800枚となった。露光時間1秒の他にCCDカメラの画像読み込み時間2秒の待ち時間があるため、全撮影には約40分を要した。露光中以外はX線シャッターを閉じて試料へのX線照射は最低限に留めた。
CT再構成には、記録した回折パターンにおいてケラチンと脂質に特徴的な部分の積分強度を用いた。毛髪は傾いていることもあるので、まず赤道線の散乱を用いて赤道線が水平になるように回転してから、ケラチンについては、図3bに示すq=0.7 nm-1付近の四角い領域を用いた。脂質については全方位を円周積分し、動径方向q=1.5 nm-1の領域とした。どちらも、積分領域の小角側と広角側の強度を内挿してバックグラウンドを差し引いた。
それぞれの回転角においてこれらの領域の積分強度を求め、それを一次元に並べて1次元強度分布を作り、これをCT再構成におけるX線吸収量として用いた。この1次元強度分布の試料を水平に動かしたときの変化を2次元マップとして作成した(図4a,c)。これはCT再構成におけるシノグラムに相当する。毛髪外における強度はゼロとした。このシノグラムを元に、filtered back projection法によってCT再構成を行った(図4b,d)。再構成ソフトウェアは、SPring-8で開発したもの[5]を使用した。
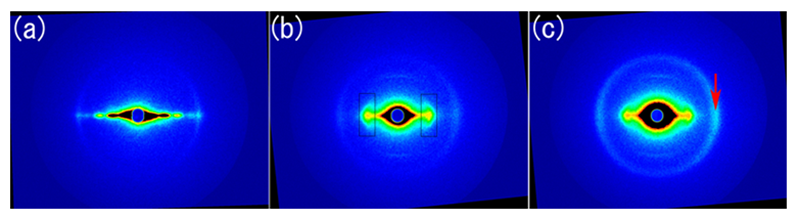
図3. ヒト毛髪から得られたX線回折パターン。(a)X線ビームがキューティクルのみを透過している場合、(b)X線ビームがキューティクルとコルテックスを透過している場合、(c)X線ビームが毛髪中心部(キューティクル、コルテックス、メデュラ)を透過している場合。(b)の四角は、ケラチンからの回折を定量した部分、(c)の矢印は脂質の回折を示す。
結果および考察:
このようにして得られたシノグラムおよび再構成された毛髪の断面像を図4に示す。この毛髪は、結果の確認が容易なように敢えて断面が円形ではないものを選んでいる。図4bはケラチンによる回折ピークを用いて再構成したもので、コルテックスの値が高く、メデュラの値が低い。これはコルテックスがケラチン繊維によって作られており、中央に空隙があることと一致する。図4dは脂質に由来する回折ピークを用いたもので、メデュラの値が高く、キューティクルにも多少値が高い領域がある。これは、赤外分光イメージングによって得られた毛髪中の脂質の分布[6,7]と似ており、回折トモグラフィーにおいても脂質の分布が得られていることを示している。
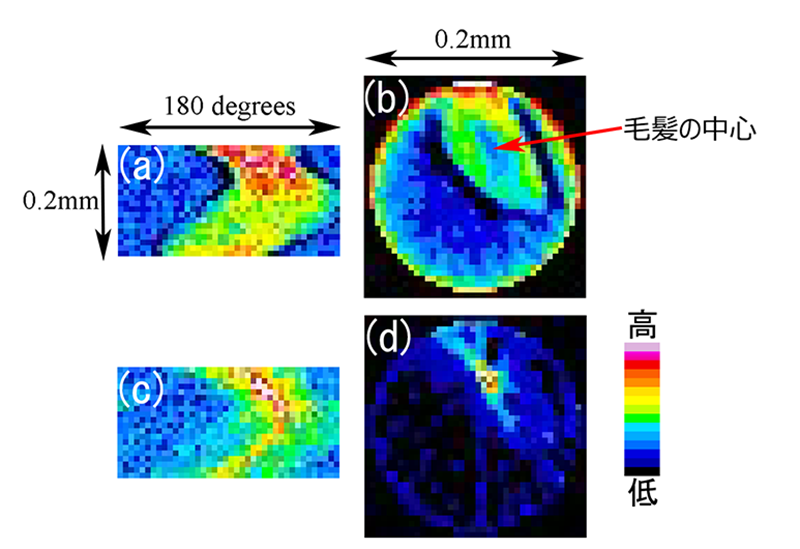
図4. ヒト毛髪のマイクロビーム回折CT (a)ケラチンのシノグラム。(b)ケラチンの再構成像、(c)脂質のシノグラム、(d)脂質の再構成像。(b)と(d)において、円形の視野の右上方にある楕円形の領域が毛髪である。(a)と(c)のシノグラムでは、水平軸が試料の回転、垂直軸が並進に相当する。
今後の課題:
本実験においては毛髪内部の物質分布が可視化されており、マイクロビームX線回折トモグラフィーがBL40XUにおいて可能であることが明らかとなった。毛髪の場合、ケラチンの回折ピークと脂質の回折ピークは重なることはなく、独立に定量可能である。毛髪のように細い試料であれば、15 keV程度のX線エネルギーを用いれば吸収補正の必要もなく、画像再構成は容易である。しかし、毛髪の最大の問題はキューティクルのCMCに由来する強い赤道反射で、これが赤道線上でケラチン、脂質両方の回折ピークと重なっている。そのため、キューティクル層におけるケラチンや脂質の分布は正しく得られているとは考えられない。図4aのシノグラムで毛髪両端の強度が低くなっているのは、キューティクル由来の強い回折が赤道線上でケラチンのピークと重なっており、バックグラウンドを差し引く際に内挿が正しく行われないためである。ケラチンと脂質の回折強度の定量の際に、赤道線付近を除外してキューティクルのCMCからの寄与を取り除くことも試みたが、キューティクルからの回折は非常に強く、完全に取り除くことは困難であった。またケラチン繊維は繊維軸上にも回折ピークを示すのでこれを用いた再構成も行ったが、回折強度が不十分なため、得られたマップにはノイズが多かった。
これはこのX線回折トモグラフィーに特有の原理的な問題であるが、キューティクルのようにX線を照射する方向によって回折強度が異なる構造を持つ物質の場合には、その分布を再構成演算によって正しく求めることができない。実験前に、本手法が適用できる試料であることを確認しておく必要がある。
キューティクルの回折の問題を除くと、実験上の最大の問題は放射線損傷であった。本実験では特に脂質の放射線損傷がひどく、撮影枚数を重ねるごとに脂質由来の強度が低下する傾向が認められた(図4c)。損傷を防ぐために低温窒素ガスを吹き付けてクライオ状態で回折を記録する試みも行ったが、試料の振動や霜の付着などの原因で質の良いデータは得られなかった。放射線に強い試料に限定される手法であることに留意すべきである。
参考文献:
[1] J A Grant, J R Davis, P Wells and M J Morgan. Opt. Eng. 33, 2803 (1994).
[2] U Kleuker, P Suortti, W Weyrich and P Spanne. Phys. Med. Biol. 43, 2911 (1998).
[3] T H Jensen, M Bech, O Bunk, A Menzel, A Bouchet, G Le Duc, R Feidenhans'l, F Pfeiffer. NeuroImage 57, 124 (2011).
[4] N Ohta, T Oka, K Inoue, N Yagi, S Kato and I Hatta. J. Appl. Cryst. 38, 274 (2005)
[5] http://www-bl20.spring8.or.jp
[6]L M Miller and P Dumas. Biochim. Biophys. Acta 1758, 846 (2006)
[7] クラシエホームプロダクツ株式会社 http://www.spring8.or.jp/ja/news_publications/press_release/2013/131212/
ⒸJASRI
(Received: August 13, 2015; Early edition: September 25, 2015; Accepted: December 11, 2015; Published: January 25, 2016)






