Volume3 No.2
SPring-8 Section A: Scientific Research Report
AAA+プロテアーゼFtsHのAAA+ドメインのATP加水分解中間体構造解析
X-ray Crystallographic Analysis of AAA+ Domain of AAA+ Protease FtsH bound with ADP Aluminium Fluoride
a京都大学 医学研究科, b名古屋大学 理学研究科, c京都産業大学 総合生命科学部
a Department of Cell Biology, Graduate School of Medicine, Kyoto University, b Division of Biological Science, Graduate School of Science, Nagoya University, c Department of Molecular Bioscience, Faculty of Life Sciences, Kyoto Sangyo University
- Abstract
-
多くのAAA+プロテアーゼはリング構造を形成し、その中心の孔に基質ポリペプチド鎖をATP依存的に通して内部のプロテアーゼ活性部位に送り込むと考えられている(pore & chamberモデル)。その機能を発現するためにはATP加水分解に伴う構造変化が重要であることが知られているが、各反応ステップにおける詳細な分子機構の情報は未熟である。我々は膜結合型AAA+プロテアーゼFtsHのAAA+ドメインの構造変化に着目してX線結晶構造解析を行い、ATP加水分解中間体構造を決定した。構造情報からヌクレオチドの結合状態や構造変化を明らかにし、ATP依存的に構造変化することを原子分解能で明らかにした。
キーワード: AAA+プロテアーゼ、ATP加水分解、蛋白質の品質管理
背景と研究目的:
FtsHやプロテアソームなどのATP依存性プロテアーゼ(AAA+プロテアーゼ)はリング構造を形成し、ATP依存的に中心の孔に基質ポリペプチド鎖を通して内部のプロテアーゼ活性部位に送り込むと考えられている。その際、基質を一度も離すことなく連続的に分解する。膜タンパク質であるFtsHは、主に複合体形成に失敗して機能を失った膜タンパク質を膜から引きずり出して分解する。その動力源となっているのがATP加水分解による構造変化であり、その反応過程の構造を決定することはFtsHの機能発現の分子メカニズムの理解に重要である。これまでに膜貫通領域を欠損させたFtsHはThermus thermophilus HB8由来でADP結合型が、Thermotoga Maritima由来でADPおよびapo型の構造が決定されている[1,2,3]。AAA+ドメインについてはE.coliやThermus thermophilus由来でAMPPNP結合型、ADP結合型、apo型の構造が決定されているが、ATP加水分解中間体の構造は未知であった[4,5]。今回、我々はATP結合・加水分解を行うドメインであるAAA+ドメインに着目してX線結晶構造解析を行い、ATP加水分解依存的な構造変化を明らかにすることを目的とした。
実験:
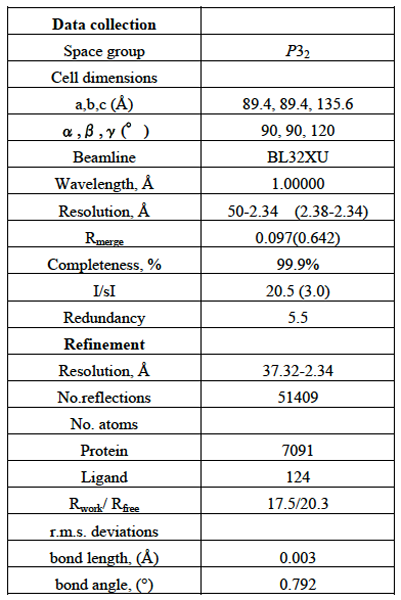
C末端にHisタグを導入した膜貫通領域を欠損させた好熱菌由来FtsHのコンストラクトを作製し、Ni-NTA Sepharoseを用いて精製した。ADP・AlFx存在下で蒸気拡散法によって結晶化スクリーニングを行い、数種の条件から結晶を得た。各結晶化条件から得られた結晶をSPring-8のBL41XUおよびBL32XUにおいて結晶の質の確認およびデータ収集を行った。最終的には2.4 Å分解能の回折データを収集した。既に得られている好熱菌Thermus thermophilus HB8由来のFtsHのAAA+ドメインをモデルに分子置換法によって初期位相を決定した。引き続きRefmac5[6]やPhenfix[7]を用いてモデルの修正および精密化を行い、構造を決定した。空間群は解析の結果、P32であり、twinningが起きているとしてデータを処理した。
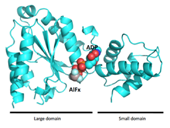
図1. ADP・AlFx結合型FtsHのAAA+ドメイン
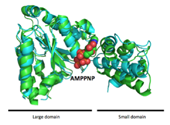
図2. FtsHのAAA+ドメインADP・AlFx結合型(シアン)とAMPPNP結合型(PDB ID: 1IY0)(緑)の重ね合わせ図
表1. X線データ測定、精密化
結果および考察:
用いたコンストラクトはプロテアーゼドメインを含んでいたが、解析の結果AAA+ドメインのみの構造であった(図1)。精製過程で分解され、AAA+ドメインのみが結晶化したと考えられた。非対称単位中に4つのAAA+ドメインが含まれていた。FtsHのAAA+ドメインはlarge domainとsmall domainからなり、その間の領域にATPが結合するWalker motifを形成している。今回決定したFtsHのAAA+ドメインのADP・AlFx結合型のヌクレオチド結合状態は、これまでに決定したATPアナログであるAMPPNP結合型構造と比較して全体の構造が大きく変化していた(図2)。Walker motifをもつATP結合タンパク質ではこれまでADP・AlFxがATPの加水分解中間体(ADP・Pi状態)を模倣した物質であることが知られている[8]。つまり、今回決定した構造はFtsHのAAA+ドメインのATP加水分解中間体であり、すでに決定されているAMPPNP結合型との重ね合わせ図から、large domainに対してsmall domainが大きく動いていることが明らかとなった。
今後の課題:
既に発表されたAAA+ドメインとプロテアーゼドメインを含んだコンストラクトでのADP・AlFx結合型構造を決定することが次のテーマであり、それが達成できれば膜結合型AAA+プロテアーゼFtsHの未知のATP加水分解中間体構造を明らかにすることができる。これまで知られているADP結合状態、apo状態の構造と比較検討することで、より詳細なATP加水分解依存的なプロテアーゼの分子メカニズムを解明したい。
参考文献:
[1] Suno R, Niwa H, Tsuchiya D, Zhang X, Yoshida M, Morikawa K, Mol Cell 22, 575-85 (2006).
[2] Bieniossek C, Schalch T, Bumann M, Meister M, Meier R, Baumann U, Proc. Natl. Acad. Sci. USA 103,3066-3071 (2006).
[3] Bieniossek C, Niederhauser B, Baumann UM, Proc Natl. Acad. Sci. USA 106, 21579-84, (2009).
[4] Krzywda S, Brzozowski AM, Verma C, Karata K, Ogura T, Wilkinson AJ, Structure 10(8), 1073-83(2002).
[5] Niwa H, Tsuchiya D, Makyio H, Yoshida M, Morikawa K, Structure 10(10), 1415-23 (2002).
[6] Murshudov GN, Vagin AA, Dodson EJ, Acta Cryst. D 53, 240-255 (1997).
[7] Zwart PH, Afonine PV, Grosse-Kunstleve RW, Hung LW, Ioerger TR, McCoy AJ, McKee E, MoriartyNW, Read RJ, Sacchettini JC, Sauter NK, Storoni LC, Terwilliger TC, Adams PD, Methods Mol Biol. 426,419-35 (2008).
[8] Menz RI, Walker JE, Leslie AG, Cell. 106(3), 331-41. (2001).
公的研究資金:
若手研究(B),特定領域研究「タンパク質分解による細胞、個体機能の防御」、「膜超分子モーターの革新的ナノサイエンス」
ⒸJASRI
(Received: January 27, 2015; Early edition: May 28, 2015; Accepted: June 29, 2015; Published: July 21, 2015)






