Volume3 No.2
SPring-8 Section A: Scientific Research Report
大腸菌複製再開始因子DnaT、PriCの構造解析
Structural Analysis of DnaT and PriC,Replication Restart Factor in Escherichia coli
九州大学 薬学研究院
Graduate School of Pharmaceutical Sciences, Kyushu University
- Abstract
-
大腸菌においては紫外線照射などで生じるDNA損傷後、DNAの修復系が作動する。修復後、蛋白質複合体プライモソームが形成され、プライモソームを起点としてDNA複製が再開始されると考えられている。本研究ではプライモソームの一つの因子であるDnaT、PriCの機能解明を目指し立体構造をX線結晶構造解析により明らかにすることを目的として実験を行った。
キーワード: Primosome、DnaT、PriC
背景と研究目的:
大腸菌においてはチミン飢餓状態や紫外線照射などで生じるDNA損傷が原因で一時的にDNA複製が停止することがある。その際には誤ったDNA配列を子孫に残さないためにDNAの修復系が作動する。修復後、蛋白質複合体プライモソームが形成され、プライモソームを起点としてDNA複製が再開始されると考えられている。プライモソームの因子であるDnaT、PriCは分子量が約20,000のαヘリックスリッチな蛋白質である。DnaTまたPriCに関しては他のプライモソーム構成因子とは異なり、構造情報が少ない。一方で、近年我々はプロテアーゼ消化によりDnaT、PriCが2つのドメイン構造を持っていることを明らかにした[1,2]。DnaTに関してはDnaT-C末ドメイン(89-179)の構造(PDBid:2RU8)をNMRによって解析し、一本鎖DNAとの結合活性を持っていることを明らかとした[1]。さらにDnaT-N末ドメイン(1-88)がDnaTと相互作用すると考えられているプライモソーム蛋白質PriBと結合する部位を持ち、ホモ三量体形成をしていることを見いだした[1]。一方で、PriCに関してはPriC-N 末ドメイン(1-97)の構造(PDBid:2RT6)をNMRによって解析した[3]。さらに-C末ドメインの機能である一本鎖DNA およびSSB(single stranded DNA binding protein)との結合を20数種の変異体を作成し、評価した[4]。
そこで今回は未だ構造の解かれていないDnaT-N末ドメインおよびPriC-C末ドメインを結晶化し、X線結晶構造解析により立体構造から機能を議論することを目的として、実験を行った。
実験:
大腸菌から発現・精製したDnaT-N末ドメイン(1-88)を以前結晶が得られていた条件にて結晶化させた。さらにハンプトン社のクリスタルスクリーンキットを使って、さらに別の結晶化条件を探した。また、大腸菌発現系から精製したPriC-C末ドメイン(96-175)をハンプトン社のクリスタルスクリーンキットを使って、結晶化条件を探した。得られた結晶はBL38B1ビームラインに持ち込み、1 Åの波長で、30秒露光で測定した。データ処理はBL38B1ビームラインのHKL2000を用いた。また、クライオ測定のためのクライオ条件の決定を行った。PriC-C末ドメインに関しては大腸菌発現系を用いて、セレノメチオニン含有蛋白質を作成し、XAFS測定を行った。
結果および考察:
1)DnaT-N末ドメインの結晶評価
大腸菌から発現・精製したDnaT-N末ドメイン(1-88)を以前結晶が得られていた条件にて結晶化させたところ、0.3 mm程度の比較的大きな針状結晶が得られた(図1、左)。この結晶をBL38B1で評価したところ、回折点は観測されなかった。
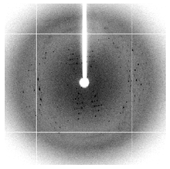
一方で、ハンプトン社のクリスタルスクリーンキットを使って、別の結晶化条件で結晶化を行ったところ、あるスクリーニング条件で0.1~0.2 mmの六角形結晶が得られた(図1、右)。この結晶化条件を中心に種々の条件を検討した。次にクライオ条件を検討し、100 Kにて結晶の評価を行った。1 Åの波長で、20秒露光で測定したところ、図2のような回折点が得られ、最大分解能で約8 Åであった。このDnaT-N末ドメインの結晶の空間群はP23であり、格子状数はa=b=c=219 Åであることがわかった。
図1. DnaT-N末ドメインの結晶
図2. BL38B1におけるDnaT-N末ドメインの回折像
2)PriC-C末ドメインの結晶評価
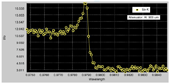
大腸菌から発現・精製したPriC-C末ドメイン(96-175)をハンプトン社のクリスタルスクリーンキットを使って、結晶化を行ったところ、長方形の結晶が得られた(図3)。この結晶化条件を中心に種々の条件検討を検討し、クライオ条件を検討し、100 Kにて結晶の評価を行った。1 Åの波長で、10秒露光で測定したところ、図4のような回折点が得られ、最大分解能で約4 Åであった。このPriC-C末ドメインの結晶の空間群はC2であり、格子状数はa=72 Å、b=132 Å、c=48 Å、β=124°であることがわかった。また、大腸菌発現系を用いて、セレノメチオニン含有蛋白質を作成し、XAFS測定を行い、結晶中にセレンが含まれていることを確認した(図5)。
図3. PriC-C末ドメインの結晶 図4. BL38B1におけるPriC-C末ドメインの回折像
図5.セレノメチオニン含有PriC-C末ドメインのXAFS測定の結果
今後の課題:
各蛋白質共通の課題として、分解能が低いため、構造解析まで行き着くことができない。よって、今後分解能の改善の検討が必要である。そのために、更に結晶化条件、クライオ条件を検討することが必要と考えている。DnaT-N末ドメインに関しては、結晶の成長が遅く、解析用の大きさになるまでに1ヶ月程度かかるため、変異体を作ることを検討している。PriC-C末ドメインでは、結晶の成長は比較的早いが、蛋白質のロットにより、結晶が出来ないことがあるため、精製条件の検討を考えている。これらの条件検討を行うことで、今後構造解析への道が開けると考えている。
謝辞:
本研究はJSPS科研費23570140および2011年度日本応用酵素協会研究助成金の助成を受けたものです。ここに感謝の意を表します。
参考文献:
[1] Saki Fujiyama, Yoshito Abe, Jun-ichi Tani, Masashi Urabe, Ken-ichi Sato, Takahiko Aramaki,Tsutomu Katayama, Tadashi Ueda, FEBS Journal, 281, 5356-5370 (2014)
[2] Takahiko Aramaki, Yoshito Abe, Takatoshi Ohkuri, Tomonori Mishima, Shoji Yamashita, TsutomuKatayama, Tadashi Ueda, Genes to Cells, 18, 723-732 (2013)
[3] Takahiko Aramaki, Yoshito Abe, Tsutomu Katayama, Tadashi Ueda, Protein Science, 22, 1279-1286 (2013)
[4] Takahiko Aramaki, Yoshito Abe, Kaori Furutani, Tsutomu Katayama, Tadashi Ueda, Journal of Biochemistry, 157, 529-537 (2015)
ⒸJASRI
(Received: January 29, 2015; Early edition: April 28, 2015; Accepted: June 29, 2015; Published: July 21, 2015)