Volume3 No.2
SPring-8 Section A: Scientific Research Report
フリッパーゼ型ABCトランスポーターの高分解能X線結晶構造解析
High Resolution X-ray Crystallographic Analysis of Flippase-type ABC Transporter
a京都大学大学院薬学研究科構造生物薬学分野, b東京大学大学院理学系研究科化学専攻生物有機化学研究室
aDepartment of Structural Biology, Graduate School of Pharmaceutical Sciences, Kyoto University, bDepartment of Chemistry, Graduate School of Science, The University of Tokyo
- Abstract
-
MsbAはABCトランスポータースーパーファミリーに属するタンパク質であり、Lipopolysaccharideの前駆体であるLipidAを細胞内膜の脂質二重層の内葉側から外葉側に輸送するフリッパーゼとしての機能を持つ。本研究では、Esherichia coli 由来MsbA(EcMsbA)の高分解能立体構造解析の実現を目指して各種結晶の調製とX線回折実験を行った。
キーワード: ABCトランスポーター、MsbA、X線結晶構造解析
背景と研究目的:
ABCトランスポータースーパーファミリーに属するMsbAは、細胞外膜で生体保護に重要なLipopolysaccharideの前駆体であるLipidAを細胞内膜脂質二重層の内葉側から外葉側に輸送するフリッパーゼとしての機能を持つ膜タンパク質である。このフリッパーゼ活性の基質認識、基質輸送メカニズムは明らかになっていない。EcMsbAの立体構造は、Wardらによって内向型構造が分解能5.3 Åで決定された[1]。さらに我々は、EcMsbAのC末端21残基(H562-Q582)からなる2本のαへリックスを欠失させたEcMsbA(ΔC21)の結晶を調製し、BL41XUにおいて4.5 Å分解能のX線回折強度データを収集した。このデータを解析したところEcMsbA(ΔC21)は外向型構造をしていることが判明した[2]。この研究では結晶格子へのEcMsbA分子の充填を変換することで異なる構造の捕捉に成功した。
しかし、いずれの構造も分解能が低く、分子メカニズムを明らかにするには不十分であった。そこで、分解能向上に寄与すると考えられる要因として、結晶中の溶媒含量、リガンドとの共結晶化による立体構造安定化、結晶化条件の再探索、部位特異的変異導入による格子中での分子間接触面積の増加を検討した。
実験:
EcMsbA(ΔC21)およびEcMsbAのC末端領域(V555–Q582)をSAV1866のC末端領域(H552–L578)に置換したキメラ変異体(EcMsbA(chimera))は大腸菌株C41(DE3)を用いて組換え発現させた。SAV1866は、高分解能(3.0 Å)で構造決定されているStaphylococcus aureus由来のABCトランスポーターである[3]。大腸菌破砕上清を1%(w/v) β-UDMにて可溶化した後、超遠心にて不溶画分を除去した。得られたサンプルをヒスチジンタグ用アフィニティ樹脂に結合した後、20 mM Tris-HCl pH8.0もしくはpH7.5,300 mM NaCl, 300 mM Imidazole, 0.02%(w/v) β-UDTMの組成の溶液にて溶出させた。Thrombinによりヒスチジンタグを切断したのち、ゲルろ過用溶液(20 mM Tris-HCl pH8.0もしくはpH7.5, 150 mM NaCl,0.02%(w/v) β-UDTM)を用いてゲルろ過クロマトグラフィーを行った。濃縮後、2.0–2.5 mM AMP-PNP,6–10 mM MgCl2またはCoCl2, 2.5%(w/v) 1,2,3-heptanetriolとなるように添加し、タンパク質濃度7–8 mg/mLの結晶化サンプルを調製した。ただし、新たに取得したペプチド性結合リガンドとの共結晶化では、タンパク質濃度32 μM(2 mg/mL)のEcMsbA(ΔC21)精製標品にリガンドを40 μMになるように添加し、4℃で一晩インキュベートした後、濃縮して結晶化に用いた。
結晶化はsitting drop蒸気拡散法にて行った。沈殿剤として22–30%(w/v) PEG400、ただし結晶化条件の再探索の検討ではPEG550MMEを用い、主に緩衝液として0.1 M Tris-HCl pH7.5、添加物としてナトリウム塩を含む条件で結晶が得られた。これらの結晶は、結晶ドロップのPEG400またはPEG550MMEの濃度を30–40%(w/v)まで高くしたのち、ループに回収して液体窒素にて凍結させた。ただし、新たに取得したリガンドとの共結晶については、PEG400は29%(w/v)のままPEG2000MMEを18%(w/v)になるように加えたのち、結晶を回収、凍結した。X線回折実験はBL41XUにおいて100 Kの温度下、検出器にRayonix社製MX225HEを用いて行った。測定の際の測定条件は表1に示した。得られた回折イメージはプログラムCrystal Clearにて処理した。
結果と考察:
1. 結晶中における溶媒含量の検討
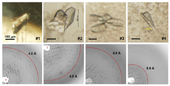
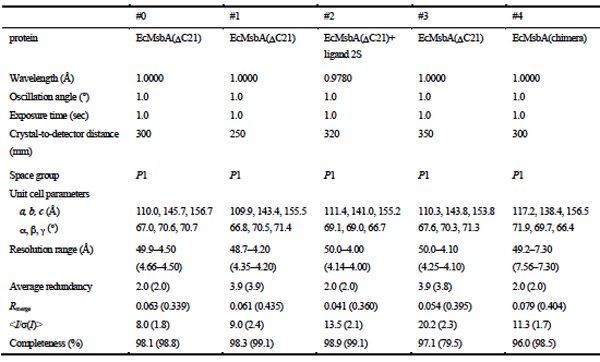
脱水処理によって結晶の溶媒含量を減らすことにより、結晶中の分子がより高い規則性を持って密に充填され、分解能が改善することが知られている[4]。そこですでに得られているEcMsbA(ΔC21)結晶に対して、クライオプロテクタント溶液内のPEG400濃度を30, 35, 40, 45, 60%(w/v)へと高め、結晶中の溶媒含量変化による分解能への影響を検討した。その結果、40%(w/v)のときに4.2 Å分解能においてRmerge=6.1%のX線回折強度データ#1が得られた(図1-#1、表1-#1)。すでに報告済みであるEcMsbA(ΔC21)のデータ#0[2]と比較したところ、わずかながら分解能の向上は見られたものの、データの大きな改善には至らなかった(表1)。
2. リガンドとの共結晶化による立体構造安定化の試み
リガンドとの複合体形成によって結晶中での分子構造を安定化するために、RaPIDシステムを用いた環状ペプチドのライブラリー[5,6]からEcMsbA(ΔC21)に結合するリガンドのスクリーニングを行った。得られた新規リガンド2SとEcMsbA(ΔC21)との複合体結晶(図1-#2)のX線回折実験を行った結果、4.0 Å分解能においてRmerge=4.1%でデータ#2を得た(表1-#2)。
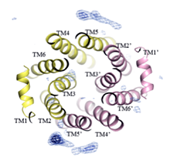
プログラムPhaserを用いた分子置換法により位相決定後、phenix.refineにて構造精密化を行った。その結果、膜貫通へリックスTM2, TM5, TM4の近傍に差電子密度(Fo-Fc)を新たに観測することができた(図2)。その電子密度はリガンド2Sの一部である可能性が示唆されたが、不明瞭なものであった。これは、リガンド2Sの結合が不安定であるためと考えられる。したがって、より強固に結合するペプチドを選抜する方法の検討が必要であることが示唆された。
3. EcMsbA(ΔC21)の結晶化条件の再検討
沈殿剤および添加物の種類についてEcMsbA(ΔC21)の結晶化条件の再探索を行った。その結果、沈殿剤にPEG550MME、緩衝液に0.1 M glycine pH8–9、添加物にNaNO3を用いた新規の条件により、結晶が得られた(図1-#3)。X線回折実験の結果、4.1 Å分解能においてRmerge=5.4%でデータ#3を取得した(表1-#3)。データ#0及び#1と比較すると、空間群が同じP1であり、単位格子定数が類似していた(表1)。EcMsbA(ΔC21)は結晶が得られた条件も類似していたことも考え合わせると、分解能の向上にはタンパク質自体の大きな改良が必要であると考えられた。
表1. 各データセットの測定条件と統計値
4. 結晶格子中での分子間接触面積の増加を目的とした部位特異的変異導入の検討
膜タンパク質の結晶の分解能を向上させるには、結晶格子中での分子間接触面積の増加が必要であると考えられる[7]。そこで、外向型構造の中で最も高い分解能(3.0 Å)で構造決定されているSAV1866[3]の結晶構造を観察したところ、SAV1866のNucleotide Binding Domain(NBD)間で見られる相互作用はEcMsbA(ΔC21)のNBD間で見られる相互作用とは異なっていた。この相互作用にはSAV1866のC末端側のH552-H565の領域が関与していた。したがって、この部分を含む領域をEcMsbAの相当する領域と変換すれば結晶中の分子間接触部位に変化が起こる可能性があると考えられた。
そこで、EcMsbAのC末端領域(V555–Q582)をSAV1866のC末端領域(H552–L578)に置換した変異体EcMsbA(chimera)を作製した。EcMsbA(chimera)を精製し、結晶化条件スクリーニングを行ったところ、図1-#4に示す結晶が得られた。この結晶を用いてX線回折実験を行った結果、得られたデータは7.3 Å分解能においてRmerge=7.9%であった(表1-#4)。本変異体の検討結果から、適切に分子間接触部位を導入するためには、単に他のタンパク質の配列と置換するだけでなく、改変後の分子内と分子間相互作用面の立体化学的相補性を考慮した設計が必要であることが示唆された。
図1. EcMsbA変異体の結晶(上)とそれぞれから得られた回折イメージ(下)。
図2. データ#4の差電子密度マップ(Fo-Fc, 3σ)をEcMsbA(ΔC21)の細胞外側から見た図。
リボンはEcMsbA(ΔC21)のモデル構造を示す。
今後の課題:
本課題で得られた結果の分析により、EcMsbAの高分解能での構造解析には、構造のさらなる安定化が必要であることが示唆された。そこで、骨格構造が共通のホモログと比較してタンパク質工学的な改変を加えEcMsbAの構造を安定化させることを計画している。すなわち、我々が高分解能で構造決定したABCトランスポーターCmABCB1[8]との構造比較に基づいて、安定性への寄与が推測される特徴をEcMsbAに導入し、熱安定性の高い変異体の取得を目指すものである。
参考文献:
[1] A. Ward, et al, Proc. Natl. Acad. Sci. U.S.A., 104, 19005 (2007).
[2] K. Terakado, et al., Acta Crystallogr. D Biol. Crystallogr., 66, 319 (2010).
[3] R. J. Dawson and K. P. Locher, Nature, 443, 180 (2006).
[4] B. Heras and J. L. Matin, Acta Crystallogr. D Biol. Crystallogr., 61, 1173 (2005).
[5] C. J. Hipolito and H. Suga, Cur. Opin. Chem. Biol., 16, 196 (2012).
[6] Y. Yamagishi, et al., Chem. Biol., 18, 1562 (2011).
[7] R. M. Bill, et al., Nat. Biothechnol., 29, 335 (2011).
[8] A. Kodan, et al., Proc. Natl. Acad. Sci. U.S.A., 111, 4049 (2014).
ⒸJASRI
(Received: February 3, 2015; Early edition: May 28, 2015; Accepted: June 29, 2015; Published: July 21, 2015)