Volume3 No.2
SPring-8 Section A: Scientific Research Report
γ-レゾルシン酸分解経路遺伝子群由来GraEタンパク質の結晶構造解析
Crystal Structure Analysis of GraE Protein from the Gene Cluster of γ-Resorcylate Catabolic System
a京都大学化学研究所, b関西大学化学生命工学部生命・生物工学科
aInstitute for Chemical Research, Kyoto University, bDepartment of Life Science and Biotechnology, Faculty of Chemistry, Materials and Bioengineering, Kansai University
- Abstract
-
γ-レゾルシン酸代謝に係る遺伝子群由来で機能不明なGraEタンパク質の立体構造-機能解析を行うため、Native結晶の4 Å分解能の回折強度データおよびセレノメチオニン置換体結晶に対し3波長で6 Å分解能の回折強度データを収集し、両結晶の空間群をP21212と決定した。分子置換法および多波長異常分散法による構造解析を試みたが、結晶の回折能が低く放射線損傷が大きいために、データ分解能が不十分で未だ妥当な解が得られず、解析続行中である。
キーワード: X線結晶構造解析、γ-レゾルシン酸代謝、根粒菌、GraEタンパク質
背景と研究目的:
γ-レゾルシン酸は医薬品や樹脂の原料として重要な化合物であるが、化学合成による製造では混在する副生成物の分離が問題となっている。そこで、微生物や由来酵素を利用した効率的なγ-レゾルシン酸生産系の確立を目的に有効な菌のスクリーニングが行われ、γ-レゾルシン酸を炭素源として生育する根粒菌Rhizobium sp. strain MTP-10005が単離された。遺伝子解析と酵素科学解析により、γ-レゾルシン酸の代謝系は遺伝子クラスターgraRDAFCBEKの遺伝子産物の関与により構成されており、γ-レゾルシン酸が3-オキソアジピン酸まで分解され、TCAサイクルへ導入されていくことが判明した[1,2]。γ-レゾルシン酸を始めとする芳香族化合物の微生物による代謝に関する詳細な構造生物学的知見を得るため、当研究室ではγ-レゾルシン酸代謝系酵素群の立体構造-機能解析を行っており、graA, graC, graDの遺伝子産物についてもX線結晶構造解析が進行中である。
graE遺伝子産物であるGraEタンパク質(アミノ酸残基数:112)については、同じ遺伝子群の他のタンパク質と異なりその機能は不明である。GraEタンパク質とのアミノ酸配列の同一性が20%弱であるHaemophilus influenzae菌由来YciIタンパク質の立体構造が構造ゲノム科学プロジェクトにおいて報告されているが、これについても機能は明らかとはなっていない[3]。
本研究ではGraEタンパク質のX線結晶構造解析を行い、立体構造を基にしてγ-レゾルシン酸代謝系関連化合物との係りを標的に絞った機能解析を行うことによってGraEタンパク質の代謝系中での役割と機能の解明を行うことを目的としている。
実験:
Hisタグ付加GraEタンパク質のNative結晶およびセレノメチオニン(Se-Met)誘導体結晶は、NaH2PO4, K2HPO4を沈殿剤とするシッティングドロップ蒸気拡散法により得られた(図1)。ADSC社製CCD検出器Quantum210を搭載したSPring-8構造生物学ビームラインBL38B1においてX線回折実験を行った。クライオプロテクタントとしてParatone-Nを用い、結晶を温度100 Kの液体窒素気流中で瞬間冷却後に同低温下でのデータ収集を行った。最大で0.25 × 0.1 × 0.01 mm程度の大きさの結晶を実験に使用した。1フレームあたりの振動角を1°、露光時間を20秒とし、振動範囲180°で180枚の回折像を測定した。波長1.000 ÅでNative結晶のX線回折実験を行い、4 Å分解能の回折強度データを収集することができた。プログラムiMosflmを使用して回折強度データの処理を行い、空間群をP21212、格子定数a = 87.05 Å, b = 164.39 Å, c = 37.71 Åと決定した。

図1.GraEタンパク質のNative結晶
表1.X線データ収集の統計値(括弧内は最外殻値)
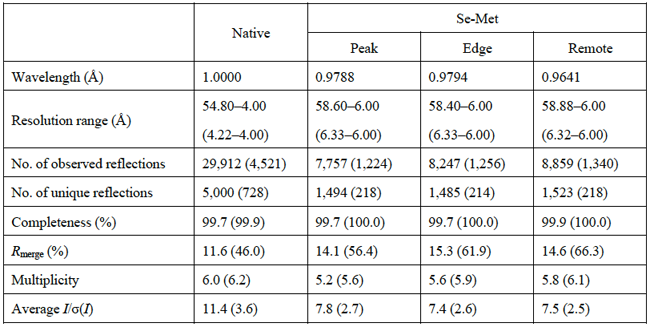
また、Se-Met誘導体結晶に対しXAFS実験を行い、Se原子に対応した吸収端スペクトルを測定した。Se原子吸収端近傍の3波長(0.9788 Å, 0.9794 Å, 0.9641 Å)でX線回折実験を行い、それぞれ6 Å分解能の回折強度データを収集した。Se-Met誘導体結晶はNative結晶と同型で、ほぼ同じ格子定数であった。X線データ収集に関する統計値を表1に示す。
結果および考察:
本結晶の非対称単位中の分子数は、VM値の一般的な範囲(1.7~3.5 Å3/Da)を考慮すると、モノマー3~5分子(VM値3.15~1.89 Å3/Da)と推測された。4 Å分解能のNativeデータに対し、プログラムMolRepを使用し分子置換法による位相決定を試みた。計算には初期モデルとしてYciIタンパク質のサブユニットおよび2量体の二種類を使用し、回転関数探索の積分半径を19 Åとした。それぞれの場合において、サブユニット2個および2量体3分子に相当する解が得られたが、各モデルから一部のαへリックスを除外して計算したオミットマップにおいて該当箇所での電子密度の消失が確認されたので、正しい解は得られていないと判断した。
次に、3波長で測定した6 Å分解能のデータセットに対し多波長異常分散法による位相決定を試みた。Hisタグ付加GraEタンパク質分子中のメチオニン残基数は、Hisタグ領域の1個を含め分子全体(アミノ酸132残基)で5個であり、Se-Met誘導体結晶の非対称単位中にSe原子は15~25個存在することになる。プログラムSOLVE/RESOLVEを使用し、非対称単位中に3, 4, 5個の分子が存在する前提で計算したところ、それぞれ5, 18, 13個のSe原子サイトが算出された。しかしながら、どの場合においても計算された電子密度図は解釈が困難であった。
Native結晶のX線回折像を観察すると、1枚目では分解能が4.0 Åまでの反射が得られていたが、180枚目では分解能が4.6 Åに低下していた。また、Se-Met誘導体結晶の多波長測定では、1波長目の1枚目では分解能が5.7 Åまでの反射が得られていたが、3波長目の180枚目では分解能が6.6 Åに低下していた。結晶の回折能が低く、また、放射線損傷が大きく各データセットで測定の進行に伴って回折分解能が低下したため、構造解析可能な分解能までの回折強度データを収集できていないことが、構造決定が成功しなかった原因と考えられる。
今後の課題:
今後は、他の結晶化条件の検索を行うとともにクライオプロテクタントの種類やアニーリング条件などの検討を行って、本結晶の回折分解能の改善を目指す。本結晶は細長い板状であるため、マイクロビームを使用し撮影フレームごとに少しずつ照射位置をずらして測定するヘリカルデータ収集が有効であると考えられる。また、データの完全性の割合をなるべく高く保ちつつ最少のフレーム数となるような振動範囲を設定することも試みる。
参考文献:
[1] M. Yoshida, N. Fukuhara, T. Oikawa, J. Bacteriol. 186, 6855–6863 (2004).
[2] M. Yoshida, T. Oikawa, H. Obata, K. Abe, H. Mihara, N. Esaki, J. Bacteriol. 189, 1573–1581 (2007).
[3] M. A. Willis, F. Song, Z. Zhuang, W. Krajewski, V. R. Chalamasetty, P. Reddy, A. Howard, D.Dunaway-Mariano, O. Herzberg, Proteins 59, 648–652 (2005).
ⒸJASRI
(Received: January 18, 2015; Early edition: April 28, 2015; Accepted: June 29, 2015; Published: July 21, 2015)






