Volume3 No.2
SPring-8 Section A: Scientific Research Report
iPS細胞の腫瘍解析に向けたマウス標本の全身CT撮影
A Whole Body CT Study of Mouse for Tumor Analysis of Transplanted iPS Cells
a大阪大学医学系研究科心臓血管外科学
b(公財)高輝度光科学研究センター
aDepartment of Cardiovascular Surgery, Osaka University Graduate School of Medicine
bJASRI.
- Abstract
-
iPS細胞の腫瘍解析を目指して、マウス全身の高分解能三次元CT撮影を行った。マウスは安楽死後凍結して保存し、室温に戻した後に撮影を行った。ピクセルサイズは15ミクロンである。BL20B2の幅広いビームと広い撮像範囲を持つ高分解能X線検出器を用いれば、マウスの全身撮影も比較的容易であることが示された。また、X線の屈折を用いた内臓撮影の可能性が示された。
キーワード: iPS cell, computed tomography
背景と研究目的:
iPS細胞(induced pluripotent stem cell、人工多能性幹細胞)は、様々な組織や臓器の細胞になり、再生医療への応用が期待されている。しかし、iPS細胞の実用化に向けた課題も残っている。ヒトの体細胞からiPS細胞を作製する効率の改善、作製されたiPS細胞株毎に分化能力等にバラつきがあると考えられるためにiPS細胞の標準化、iPS細胞から目的の組織や臓器の細胞に分化させる誘導技術の開発など様々な課題がある。中でも、最大の懸案事項が癌化である。iPS細胞による腫瘍には遺伝子導入(c‒mycやウイルスベクター)による腫瘍と、目的の細胞に分化誘導後に残っている未分化細胞による腫瘍がある。iPS細胞による腫瘍の性質、つまり良性か悪性かについてなど十分な検討は現在までになされていない。そこで、本研究では、iPS細胞により発生する腫瘍の性質を明らかにすることを最終目的とした。それにはマウスへ移植したiPS細胞の癌化により生じた腫瘍をマウス体内で可視化する必要があるが、可視化の方法としては高分解能CT(Computed Tomography)が最適であり、そのためにまずマウス全身のCT撮影を試みた。
実験:
腹部または背部の皮下に、HeLa細胞またはiPS細胞を移植したヌードマウスを作成した。3週間後に頚椎脱臼でマウスを安楽死させ、-20℃のフリーザーで凍結保存し、SPring-8へ凍結下で移送した。マウスは数時間かけて室温に戻した後に半円筒形プラスチック板に縦に固定し、回転ステージに載せてX線撮影を行った。
X線撮影は、BL20B2第3実験ハッチで行った。X線エネルギーは20 keVとし、検出器には浜松ホトニクス社製ビームモニタ5(蛍光体は、25ミクロン厚のP43)と、冷却CCDカメラC4880‒41Sを使用した。2 × 2ビニングで撮影し、ピクセルサイズは14.9ミクロン、視野は水平方向約30 mm、垂直方向約20 mmである。試料と検出器を離して、屈折コントラスト撮影を行った[1]。距離は40 cmと100 cmの二種類を試みたが、100 cmのほうが鮮明な画像が得られたので、主として100 cmを使用した。露光時間は250 msである。
この撮影条件では、X線の屈折を利用したエッジ強調撮影画像が得られる。試料を回転しつつ撮影を行って、600投影の画像からCT再構成を行った。再構成画像においても、X線の屈折によるエッジ強調効果が見られる[2]。全身の撮影は試料を上下方向にずらして数回に分けて撮影したデータをつなぎ合わせることで得た。このような幅広いX線ビームが得られるのはSPring-8のビームラインではBL20B2の第3実験ハッチのみであり、小動物の全身撮影には最適のビームラインであると言える。
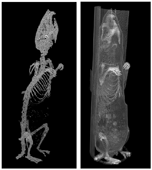
図1 マウス全身のボリュームレンダリング画像。左はコントラストを骨に合わせて骨格のみを示した。腹部に密度の高い部分が見られるのは、屈折により空気の周囲の密度が見かけ上強調されているためである。
結果および考察:
この撮影方法では全体に密度分解能が低く、高コントラストで可視化されるのは骨や肺・腸の中の空気である(図1)。しかし、腸管内蔵物によるコントラストもあり、また内臓の輪郭も見えている部分が多く(図2)、絶食などによって試料側の条件を最適化することにより、各臓器の同定が行える可能性がある。また一般的に行われるように安楽死時に血管へ造影剤を流し込んで血管を描出したり、凍結マーモセット標本の撮影で行われたように[3]、消化管に造影剤を導入することによって、消化管を描出することも可能であろう。移植した細胞はあまり増殖が進んでいないようで、明瞭な組織としては観察されなかった。これには、ホストであるマウスの免疫機能の働きが予想以上に強かった、皮下において移植した細胞への栄養血管の新生が不十分であった、移植の際の細胞の取り扱いに問題があった、などの理由が考えられる。

図2 マウス腹部の断層画像。同じ画像をコントラストを変えて表示している。マウス背部が下側である。空気の輪郭は、X線の屈折によって強調されて白く見えている。下側には固定用の半円筒形プラスチック板が見られる。マウスは粘着テープでプラスチック板に固定されている。右図の白い矢印は、細胞を移植した皮下部を示す。スケールは5 mm。
今後の課題:
今回は移植した細胞は皮下に痕跡が残る程度で可視化できなかったが、内臓の可視化が可能であれば、iPS細胞の移植方法を工夫することにより、腫瘍化した培養細胞を観察することも可能であると考えられる。また、金コロイドなどのマーカーを移植する培養細胞に取り込ませておくことにより、移植後の細胞の増殖過程や体内移動を追跡するという方法[4]も考えられる。
参考文献:
[1] N. Yagi, Y. Suzuki, K. Umetani, Y. Kohmura, K. Yamasaki. Med. Phys. 26, 2190 (1999).
[2] T. Sera, K. Uesugi, N. Yagi. Med. Phys. 32, 2787 (2005).
[3] T. Sera, H. Yokota, S. Nakamura, K. Uesugi, M. Hoshino, N. Yagi, T. Ito, K. Hikishima, H. J. Okano.Open. J. Radiol. 1, 28 (2011).
[4] C. J. Hall, E. Schültke, L. Rigon, K. Ataelmannan, S. Rigley, R. Menk, F. Arfelli, G. Tromba, S.Pearson, S. Wilkinson, A. Round, S. Crittell, R. Griebel, B. H. J. Juurlink. Eur. J. Radiol. 68, S156(2008).
ⒸJASRI
(Received: January 5, 2015; Early edition: March 25, 2015; Accepted: June 29, 2015; Published: July 21, 2015)






