Volume3 No.2
SPring-8 Section A: Scientific Research Report
小角X線散乱によるアミロイド線維形成機構に関する研究
SAXS Analysis on the Molecular Mechanism of Amyloid Formation
a京都大学原子炉実験所, b神戸大学大学院理学研究科, c京都大学化学研究所
aResearch Reactor Institute, Kyoto University, bGraduate School of Science, Kobe University, cInstitute for Chemical Research, Kyoto University,
- Abstract
-
アミロイド線維は、タンパク質のミスフォールディングにより形成されるタンパク質の超分子集合体であり、アミロイドーシスをはじめとする疾病に関わる立体構造として高い関心を集めている。本研究では、モデルタンパク質であるインスリンに注目し、小角X線散乱を用いてアミロイド線維構造の形成過程におけるタンパク質の集合機構の解明を試みた。塩濃度依存的に観察される2種類の異なる形成経路をそれぞれ解析した結果、両経路ともに初期段階での規則だった集合体形成を観測することができ、アミロイド線維形成初期イベントに関する新しい知見を得ることができた。
キーワード: タンパク質会合、アミロイド線維、小角X線散乱、中間体
背景と研究目的:
アミロイド線維は、クロスβ構造を基本構造としたタンパク質の超分子集合体である。アルツハイマー病やプリオン病、透析アミロイドーシスを代表としたアミロイドーシスと総称される疾病や、神経変性疾患など数々の深刻な疾病に関わる構造として高い関心を集めている。疾病根治にむけた創薬研究のための分子論的基盤の確立のためには、ネイティブ構造とは異なると予想されるアミロイド線維特有の構造形成原理を解明することが極めて重要である。
しかしながら、アミロイド線維は、多数のタンパク質分子によって構成される非常に巨大で不溶であるため、その立体構造及び形成過程の解明にはX線結晶構造解析や溶液NMR解析といったタンパク質科学分野で用いられてきた有効な手法の適用が著しく制限されるという問題に直面している。そこで我々は、合成高分子のゲルや結晶などに適用され、それらの階層構造やその構造形成過程の解明に多大な貢献をしてきた小角X線散乱法(SAXS)をアミロイド線維に適用することを試みた。本研究では、インスリンをモデルタンパク質として選択し、ネイティブタンパク質がアミロイド線維の構成要素としてどのように集合し、クロスβ構造を発達させていくのかという情報を時分割で詳細に得ることを目標として、時分割SAXS測定を行った。
実験:
インスリンは、酸性条件で加熱するとアミロイド線維が容易に形成されることが知られている。最近、我々はNaCl濃度を変化させると、線維前駆中間体を経由した別の経路で線維が形成されることを見つけた[1]。通常、チオフラビンT蛍光色素(ThT)の蛍光強度を用いて、アミロイド線維形成反応を追跡すると、一定期間の誘導期とこれに続く急速なアミロイド線維形成により、シグモイド様のパターンが確認される。ところが、高塩濃度条件下では線維化経路が変わり、反応開始直後に極めて高いThT蛍光強度が確認され、その後に減衰するという異なるパターンが観測された。
そこで、はじめに今回のSAXS解析で用いるインスリン濃度(5 mg/ml)において、ThT蛍光強度の経時変化のNaCl濃度依存性を確認した。線維化をより効率よく誘導するためにインスリンは0.05もしくは0.5 MのNaClを含んだ25 mM HClに溶解した。最終的なpHは約1.6であった。加熱により線維化反応を開始した結果、0.05 M NaClではシグモイド状のタイムコースが見られたのに対して、0.5 M NaClでは反応開始直後から著しいThT蛍光強度を示すという特徴が確認された(図1)。この結果に基づき、0.05 Mと0.5 M NaCl濃度で2通りの異なる線維化経路を辿ることができると判断し、それぞれの線維化過程の追跡を試みた。
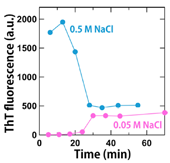
図1.ThT蛍光強度を用いて追跡したインスリンのアミロイド線維形成反応の塩濃度依存性.マジェンタは0.05 M NaCl存在下、水色は0.5 M NaCl存在下での結果を表す。
時分割SAXS測定は、波長及びカメラ長はそれぞれ1.0 Å、2183 mmの条件下でBL40B2を用いて行った。検出器はCCDとイメージングインテンシファイアを組み合わせたII+CCDを用いた。5 mg/mlのインスリン酸性水溶液を上述のThT蛍光測定と同一の組成で調製して1 mm光路長をもつ石英セルに封入し、温度コントローラーで80°Cに温度ジャンプさせることでアミロイド線維形成反応を誘導した。これに同期させて小角X線散乱同時測定を開始した。その後、4秒間隔の測定を連続的に行い、各測定の露光時間は5秒間とした。検出器により得られた二次元画像をFit2Dにより円環平均を行い一次元プロファイルに変換した後に、溶媒からの一次元プロファイルを透過率で補正した値を差し引くことでサンプル由来の一次元プロファイルを得た。なお、今回の測定においては散乱強度の絶対強度化は行っていない。
結果および考察:
特異なアミロイド線維化形成過程が観測された0.5 M NaCl条件下で時分割SAXS測定を行ったところ、時間経過に伴いlow Q(Q = 4πsinθ/λ、λは波長、2θは散乱角に対応する。)での散乱強度の増加が観測されたことから、アミロイド線維形成反応が進行していると考えられる(図2)。散乱強度の時間依存性を概観するために、0.008-0.15 Å-1の範囲の散乱強度を積分し、反応時間に対してプロットしたところ、100-200秒後に急激な強度の増大が起きていることが分かった(図3a)。この時間領域は、非常に高いThT蛍光強度が示される領域に相当し、以前の研究結果[1]に基づくと線維前駆中間体が蓄積していることが予想される。
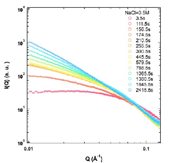
図2.0.5 M NaCl存在条件でのインスリン線維化解析で得られた時分割SAXSのプロファイル変化。
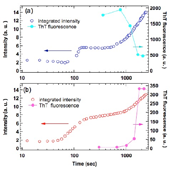
図3.(a) 0.5 M NaCl条件下で観察された積分散乱強度の時間発展(青色)。ThT蛍光強度のプロットも重ねて示している(水色)。(b) 0.05 M NaCl条件下で観察された積分散乱強度の時間発展(赤色)。ThT蛍光強度のプロットも重ねて示している(マジェンタ)。
したがって、散乱強度の増大は線維前駆中間体の形成を捉えたと示唆される。なお、同一の反応試料及び セルを使用して反応を進行させながら、632.8 nmのレーザー光源を用いた光散乱の時分割測定も行ったが、上述のSAXSによる散乱強度の増加が見られたのとほぼ同じタイミングで散乱強度の増加が見られたことから、本凝集は放射線損傷誘起によるものではなく、線維化反応に伴う凝集そのものを観察したと考えられる。また興味深いことに、線維前駆中間体は800秒あたりまで安定に蓄積しており、約1000秒後にはThT蛍光強度の減少と連動してさらなる積分散乱強度が増加した。この時間領域の変化は線維前駆中間体構造を経由したon-pathwayのアミロイド線維構造への成熟化を捉えたのではないかと考えている。
さらに興味深いことに、通常の線維化過程を経由する0.05 M NaCl条件下においても100秒あたりから顕著な散乱強度の増加が見られることが分かった(図3b)。この時間帯はThT蛍光強度がネガティブな誘導期の最中であることを考慮すると、通常の誘導期を示すタイプの線維化経路においてもアミロイド線維形成初期にはタンパク質の集合化が進行していると考えられる。
今後の課題:
SPring-8放射光を利用することによって、アミロイド線維の初期集合過程を秒オーダーで時分割測定することができ、アミロイド線維へのタンパク質集合化の様子を観測することができた。現在、各散乱プロファイルの経時変化をより詳細に捉えるために形状因子を仮定することでモデルフィッティングを試みているところであるが、反応開始直後にかなり秩序だったタンパク質集合体が形成され、その後徐々に伸長し肥大成長する傾向が確認されつつある。今後、引き続き解析を進め、核形成からクロスβ構造の成熟化までの幅広い時間スケールでの構造変化を明らかにしていきたいと考えている。
さらに我々は、各塩濃度条件で生成したアミロイド線維構造を詳細に解明するために、超小角散乱(USAXS)測定を組み合わせた解析も行っており、アミロイド線維の階層構造に差異を確認している[2]。この結果も併せて考えると、2つの経路で見られたタンパク質初期集合構造間の差異がアミロイド線維の多形を生み出している可能性も考えられる。今後、タンパク質初期集合体を比較することで構造多形も視野に含めた議論を行い、アミロイド線維形成に必要なタンパク質会合の実態を明らかにしたいと考えている。
参考文献:
[1] E. Chatani, H. Imamura, N. Yamamoto, M. Kato, J. Biol. Chem. 289, 10399 (2014).
[2] 茶谷 絵理, 井上 倫太郎, 竹中 幹人, 西田 幸次, 金谷 利治, SPring-8利用研究成果集 1,2011B1951 (2013).
ⒸJASRI
(Received: January 8, 2015; Early edition: March 25, 2015; Accepted: June 29, 2015; Published: July 21, 2015)






