Volume3 No.2
SPring-8 Section A: Scientific Research Report
チタン水素化物の高温高圧下での融解実験
Experiments on Melting of Titanium Hydride under High Pressure and Temperature
a(独)日本原子力研究開発機構, b東北大学
aJapan Atomic Energy Agency, bTohoku University
- Abstract
-
高濃度の水素を含む液体金属を探査するため、高温高圧下の水素流体中でチタン水素化物TiH2のX線回折その場観察実験を行った。試料を約5 GPaまで加圧し水素源とともに加熱したところ、一度だけ融体が観測されたが、同様の実験を複数回行っても融解は再現しなかった。再現性のない理由が不明であるため、これらの結果からTiH2の融解や液体の構造を議論することは困難と判断した。
キーワード: 水素化物、高温、高圧、融解、液体金属
背景と研究目的:
水素は常圧では分子からなる絶縁体だが、高圧下では金属になると予測されている。しかしながら、水素の金属化には非常に高い圧力が必要であり、静的な圧縮による金属化は成功していない。一方、ある種の金属は水素を高密度に固溶することが知られており、水素原子と金属原子の原子数比H/Mは、一般に遷移金属ではH/M≤2、希土類金属ではH/M≤3に達する。さらに、高温高圧の液体状態では、これよりはるかに多く水素を含む液体水素合金が存在する可能性が示唆されている[1,2]。また、このような高濃度の水素を含む状態を解明することができれば、高密度に水素を貯蔵する材料を開発する上でも有用な知見を与えることが期待される。本研究は、高温高圧X線回折その場観察実験によって、高圧下での液体の構造を調べ、高濃度の水素を含む状態を探査することを目的とする。
高温高圧下の遷移金属と水素の系に関しては、特に鉄と水素について多数の研究が報告されている。鉄は常圧では水素をほとんど固溶しないが、高圧下では急激に溶解度が上昇し、数GPaの圧力領域ではH/Mが1に近づくことが最近の研究によっても確認されている[3,4]。また、水素を固溶させると融点が数百℃と大きく低下する。これまでの実験で、我々は高温高圧下で水素を含む鉄を融解させてX線回折測定を行うことに成功した[5]。比較のため純粋な鉄も測定し、金属原子間の最近接距離に対応する2体分布関数の第1ピークの位置を比較したところ、水素を含むことによってわずかに金属原子間の距離が増加することを示唆する結果が得られた。すなわち、液体中でも結晶と同じように、水素が金属原子間に入って体積を膨張させていると考えられる。た だし、水素1原子が溶解することによる体積の膨張が結晶と液体の場合で等しいと仮定して、液体中での水素濃度を推定したところ、液体状態で水素濃度が大きく増加しているとは考えられないことが分かった[5]。
より高濃度の水素を含む液体状態を探査するため、本研究では、チタン(Ti)の水素化物の測定を行った。Tiは、常圧付近でも水素と反応して2水素化物TiH2を形成し、融解後も他の遷移金属に比べて高濃度の水素を含むことが知られている[6,7]。また、高温高圧下でのX線回折による研究も行われており、約5 GPaでは、TiH1.8が1050℃より少し高い温度で融解して、新しい固体相と共存することが報告されている[8]。この温度は、純粋なTiの常圧での融点である1638℃よりもはるかに低い。これらの結果から、実験的に到達できる高温高圧下で、水素を大量に含む液体相が存在する可能性が高いと考えられる。よって、その構造を調べるために、高温高圧下でX線回折実験を試みた。
実験:
出発試料として(株)高純度化学研究所から購入したTiH2を用いた。X線回折実験は、大型放射光施設SPring-8の日本原子力研究開発機構専用ビームラインBL14B1で行った。高温高圧の発生は、キュービック型マルチアンビルプレスで行った。試料セルの加圧には先端に6 mm×6 mmの平面を持つ炭化タングステン(WC)製のアンビルを用いた。高温高水素圧下での実験は深井らによって開発された方法を用いた[9]。高圧セルは齋藤らによってSPring-8での放射光実験に最適化されたものを使用した[10]。圧媒体はパイロフィライト製の1辺8 mmの立方体を用いた。試料容器としてパイロリティック窒化ホウ素(PBN)あるいは酸化マグネシウム(MgO)のカップおよびフタを用いた。これらは水素を透過する。水素源としては水素化リチウムアルミニウム(LiAlH4、LAH)を選択した。この水素源はTi-H系の過去の研究でも使われているもので、300℃から400℃程度で分解し、水素を放出する[8]。試料容器と水素源を、水素の封止に有効なNaCl容器の中に入れ、これをさらにグラファイト製のチューブ型ヒーターの中に入れて、圧媒体中にセットした。
入射X線として、偏向電磁石からの白色光を利用し、Ge半導体検出器を用いたエネルギー分散型のX線回折測定を行った。加圧後の圧力は、容器に用いたNaClのX線回折測定から状態方程式を用いて求めた[11]。昇温は荷重一定の条件で行った。圧力は昇温とともに変化するが、今回の実験では、トラブルの低減と試料の良質なデータの測定を優先して、高温での正確な圧力測定を行う工夫はしなかった。温度はヒーターに投入する電力から見積もった。電力と温度の関係は熱電対を使った予備実験で作成した。
結果および考察:
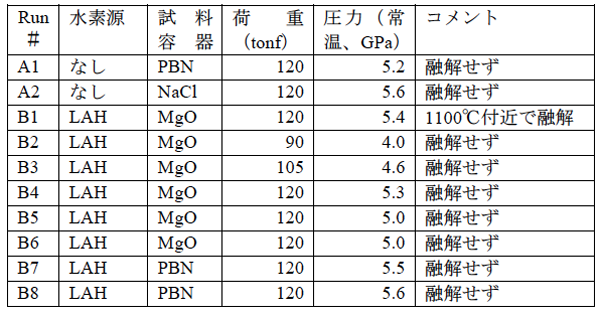
表1に本研究で行った実験の一覧を示す。実験A1では、水素源を入れずに、TiH2のみを融解させることを試みた。試料容器としてアルミニウムの水素化実験などで実績のあるPBNを使った。水素を封止するため、この容器をさらにNaClの容器に入れた。出発物質はfcc相であったが、約5 GPaまで加圧したところbct相に転移していた。これを昇温すると、600℃程度でfcc相へ転移した。TiH2のbct相とfcc相の境界の詳細な研究は、同時期に遠藤らによって行われており、その転移温度よりも高いが、加圧後1回目の昇温では2回目以降の転移温度より高い温度で転移することが示されているため、この結果は矛盾しない[12]。1000℃付近から、回折線の相対強度が大きく変化しはじめた。これは、粒成長が起きていることを示す。一方、先行研究[8]で液体の出現が観測された1050℃を超えてもバックグラウンドの強度は大きく変化せず、液体と考えられるような回折パターンは出現しなかった。NaClの5 GPaでの融点は、1458℃であるため[13]、それ以下の温度までしか加熱しなかった。1400℃では、試料と容器の境界付近に新しい回折線が出現した。常温常圧に戻した状態のX線回折パターンでピークの同定を行ったところ、新しい回折線はTiNとTiB2の回折線と一致した。すなわちTiH2は約5 GPa、1400℃付近でPBNと反応することが明らかになった。次に、実験A2では直接NaCl容器の中にTiH2を入れて、同様の実験を行った。この場合も、bct相からfcc相への相転移や、1000℃付近での回折ピークの強度の減少は見られたが、明確な融解はやはり観察されなかった。
表1.本研究で行った実験一覧
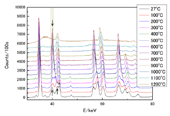
次に、実験B1では、TiH2をMgO容器に入れ、水素源であるLAHとともにNaCl容器に入れたものを約5 GPaで加熱した。MgOは水素を含んだ鉄の液体の測定に利用された実績がある[5]。図1に試料の同一位置でのX線回折パターンの温度変化を示す。回折角2θは8度である。X線エネルギーが40 keV付近のbct相の2本の回折線、110と002(図中上向き矢印)が昇温とともに1本になる様子が見て取れる。これがfcc相の200である(図中下向き矢印)。水素源がない場合と同じように、600℃程度でbct相からfcc相へ変化した。その隣りの43 keV付近の回折線は容器のMgOの回折線である(図中三角印)。さらに加熱すると、900℃から粒成長による回折線の大きな強度の変化が起きた。1100℃では、試料のこの位置では図1のように変化が見られなかったが、他の位置では幅広い散乱が出現した。さらに昇温し、1200℃では、試料全体で図1の最上段のような約37 keVに極大を持つ幅広い散乱が出現した。残った回折線は試料容器のMgOのものである。このようなある程度の強度と構造をもった散乱は液体に特有なものであり、融解が起きたと考えられる。
図1.チタン水素化物TiH2を水素源とともに約5 GPaで昇温した場合のX線回折パターンの温度変化。回折角2θは8度。縦方向にずらしてプロットした。実験B1。
これまでの遷移金属-水素系の高温高圧下での研究では、多くの金属で、水素による融点降下が約3 GPaで最大となることが報告されている[1,2]。融点の圧力変化を調べるため、圧力を変えた実験を行った。実験B3では約4 GPaで昇温したが、この場合はNaClの融点付近まで温度を上げても実験B2で観測されたような試料の融解が観測されなかった。そのため、実験B3ではB1とB2の中間の圧力である約4.6 GPaで加熱した。この場合も、NaClの融点付近まで温度を上げても融解が観測されなかった。非常に狭い圧力範囲で融点が200℃以上も変化することは奇異であるため、さらに低圧側の実験を行う前に、念のため、実験B1の再現性を確認する実験をB4として行った。その結果を図2に示す。同じ出発試料、水素源、試料容器等を用い、ほぼ同じ圧力で昇温しているにもかかわらず、融解が観測できなかった。実験B1とB4では、常温での圧力はほぼ同一であり、試料のbct相からfcc相への転移がほぼ同様に起きていること、転移後の試料のd値も大きな差はないことから、温度の再現性も200℃といった大きな差があるほど悪くないと考えられる。融解が起きない原因は不明であったが、出発試料や容器の微妙な違いが関係する可能性を考え、さらにもう一度、B5として同様の実験を行った。実験B6では昇温を一定速度で速めに行ってみた。実験B7とB8では、試料容器としてPBNを用いた。PBNは水素化の過去の数多くの実験で使用されており、最初の実験(A1)で、1400℃ではTiH2と反応することが明らかではあるが、低い温度では利用できる可能性がある。しかしながら、以上のいずれの場合も融解は観測できなかった。
図2.チタン水素化物TiH2を水素源とともに約5 GPaで昇温した場合のX線回折パターンの温度変化。回折角2θは8度。縦方向にずらしてプロットした。実験B4。
上述のように、同様な実験を複数回行ったにもかかわらず、融解は一度しか観測できなかった。融解がTiH2の本来の性質であり、他の実験では、不純物の存在や試料容器との反応、あるいはNaCl容器による水素の閉じ込めが十分できなくなった、といった何らかの原因で融解が起こらなかった、という可能性はある。しかしながら、原因が明らかでないうえ、ほとんどの場合に融解が起きなかったことから、逆に、融解が不純物の存在や試料容器との反応で起きた可能性も考えられる。そのため、今回の一連の結果からチタン水素化物の融解を議論することは不可能と判断した。
今後の課題:
融解が再現しなかった理由は不明であるが、一般に水素化物については、試料表面の状態や、微妙な製法の違いで、性質や水素の吸脱着特性に違いが生ずることが知られている。出発物質として、供給者が異なるチタン水素化物を用いて再度実験することも考えたい。また、試料容器の探査も必要である。今回の実験では、液体の測定を優先したデザインの試料構成を用いたため、TiH2の結晶構造の精密な温度圧力依存性の測定はできていない。このような精密な測定を行えば原因の解明につながる可能性がある。
謝辞:
高温高圧下の金属水素化物に関してご教示、ご討論していただいた深井有博士に感謝する。本稿の研究の一部は水素貯蔵材料先端基盤研究事業(平成19年度から平成23年度)のもとNEDOの委託を受けて実施された。放射光利用実験は、SPring-8の課題番号2011A3605、2011B3605で実施された。
参考文献:
[1] Y. Fukai, “The Metal-Hydrogen System”, Second edition, Springer-Verlag, 2005.
[2] 深井有,高圧力の科学と技術 15, 132 (2005).
[3] K. Sakamaki, E. Takahashi, Y. Nakajima, Y. Nishihara, K. Funakoshi, T. Suzuki and Y. Fukai, Phys. Earth Planet Interiors 174, 192 (2009).
[4] A. Machida, et al., Nature Commun. 5, 5063 (2014).
[5] Y. Katayama, H. Saitoh, Y. Yomogida, K. Aoki, J. Phys. Conf. Ser. 215, 012080 (2010).
[6]エヌ・ア・ガラクチノア, 金属内の水素, 改訂増補第2版, 1972 日ソ通信社, p.111.
[7]H. Nakajima, Prog. Mat. Sci. 52, 1091(2007) Fig. 1 and reference therein.
[8] K. Nakamura and Y. Fukai, J. Alloys Compounds 231, 46 (1995).
[9] 深井有, まてりあ 34, 121(1995).
[10] H. Saitoh, A. Machida, Y. Katayama and K. Aoki, Appl. Phys. Lett. 94, 151915(2009).
[11] D. L. Decker, J. Appl. Phys. 42, 3239 (1971).
[12] N. Endo, H. Saitoh, A. Machida, Y. Katayama and K. Aoki, J. Alloy Compounds 546, 270 (2013).
[13] J. Akella, S. N. Vaida and G. C. Kennedy, Phys. Rev. 185, 1135 (1969).
ⒸJASRI
(Received: November 19, 2014; Early edition: April 28, 2015; Accepted: June 29, 2015; Published: July 21, 2015)