Volume3 No.2
SPring-8 Section A: Scientific Research Report
大動脈壁弾性タンパク質の赤外吸収分光分析
FTIR Analysis of Elastic Proteins in Aortic Wall
a神戸赤十字病院, b(公財)高輝度光科学研究センター
aJapanese Red Cross Kobe Hospital, bJASRI
- Abstract
-
BL43IR赤外分光ビームラインにおいて、ヒト大動脈壁病理標本のFTIRマッピングを行った。5ミクロンピッチで40 × 60点の二次元吸収分光マップを作成することができた。3300 cm-1付近の吸収ピークの強度は、大動脈壁中膜に存在するエラスチンの弾性板と構造的に一致する分布を示したが、この結果の解釈については、今後の検討が必要である。
キーワード: 大動脈、弾性板、FTIR
背景と研究目的:
大動脈解離とは動脈壁が中膜のレベルで二層に剥離し、動脈に沿ってある長さに渡って二腔になった状態を言う。日本人に多い疾患で、適切な治療を受けないと突然死する危険性が高い。大動脈解離は以前は致死的な疾患であったが、画像診断技術や手術手技の進歩に伴い最近は予後が改善している。しかし、その原因や病態にはいまだ不明な点が多い。また一方で、penetratingatherosclerotic ulcer(PAU)やintramural hematoma(IMH)などの、大動脈解離の類縁疾患ともいうべき病態も多く報告されるようになっており、大動脈に関する研究の必要性は増している。
大動脈壁の主たる構成成分はエラスチンとコラーゲンであり、特にエラスチンは弾性タンパク質として大動脈の弾性を担う重要な働きをしている。エラスチンは大動脈中膜に円周上に配列する弾性板を形成し、その間をコラーゲン弾性線維が弾性板とほぼ垂直の方向につないでいる[1]。弾性板は厚さ2-3 mmの中膜に約50層含まれており、数十ミクロンの周期構造を成している。エラスチンは明瞭な二次構造を持たず、ランダムコイル状と考えられ、この構造が弾性の起源となっていると考えられる。しかし二次構造を持たないためX 線回折等の手法では研究しにくく、その構造には不明な点が非常に多い。フーリエ変換型赤外分光法(FTIR)は、脂質やタンパク質の分析に多用される手法で、原子同士の結合の振動モードを反映するため、ランダムコイルであっても測定が可能である。これまでに、精製したエラスチンやthin-cap fibroatheromaの赤外吸収分光測定は報告があり、エラスチンの状態によってスペクトルが大幅に異なることが知られている。しかし、大動脈の赤外分光の研究はこれまでなかった。そこで、大動脈壁におけるエラスチンの構造を調べる目的で、放射光赤外測定によるイメージングの可能性を探った。
実験:
フッ化バリウム基板に、厚さ10ミクロン程度のホルマリン固定・パラフィン包埋大動脈壁スライスを載せた。試料は神戸赤十字病院倫理委員会の承認のもと、大動脈解離手術中に、患者の同意を得て採取したものである。試料のスライスは高分子フィルム(ラップ)上に作成されていたが、高分子固有の吸収スペクトルの混入とフィルムによる干渉を防ぐために、スライスをフィルムから剥がしてマウントした。BL43IRのFTIR装置を用いて、顕微鏡下で測定範囲を設定し、自動XYステージを用いて空間分解能5-20ミクロンのマッピングを行った[2]。 赤外顕微鏡は透過配置で、検出器はMCT(テルル化カドミウム水銀)検出器を用いた。各点において550-7500 nm-1の波長領域の赤外吸収スペクトルを計測し、分解能は10 cm-1、128スキャンを平均した。一点あたりの計測時間は12秒程度であった。
解析では、タンパク質の分布を得る目的で、波長3000-3200 nm-1と3500-3800 nm-1をバックグラウンド領域とし、それぞれの最低点を繋ぐ直線補間によってバックグラウンドを除去することにより、これらで挟まれた3200-3500 nm-1領域の吸収の積分値を求めた。これはO-HとN-Hの伸縮運動に起因する吸収ピークで、包埋剤のパラフィンからは生じない。また、同様に2700-2800 cm-1と3000-3200 nm-1をバックグラウンド領域と定めて、C-H伸縮に起因するピークの積分値を求め、これで規格化を行った。このピークはパラフィンに由来する部分が大きいと思われる。
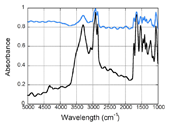
図1 ヒト大動脈壁中膜のパラフィン包埋切片から得られた赤外吸収スペクトル。代表的な2点での例を示す。吸収スペクトルは、試料上の一点で測定したスペクトルを、試料の無い場所でのスペクトルで割って透過率を求め、それを1から引くことによって求めている。
結果:
図1に、本試料から得られた赤外吸収スペクトルの典型例を示す。3300 cm-1付近の吸収ピークはN-HおよびO-Hの伸縮運動に起因するもので、主としてタンパク質由来と思われる。その隣りの2900 cm-1付近のピークはC-H伸縮運動に由来するもので、主として包埋に用いたパラフィンに由来すると考えられる。図1の吸収スペクトルは、試料の上方と下方の2点(図3a左側赤く囲った2点)で測定されたものであるが、吸収の絶対値が大きく異なっている。この原因を明らかにするために、試料中央上方から下方に17ミクロン間隔に並んだ点(図3a赤線に沿った点)について、各点における測定スペクトルの生データ(透過赤外光強度)をプロットしたのが、図2である。
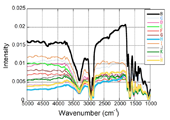
図2 ヒト大動脈壁中膜のパラフィン包埋切片から得られた赤外吸収スペクトル。試料上の複数の点における透過赤外光強度をプロットしたもの。点BからMまでは、試料上方から下方へ17ミクロンの間隔で等間隔に並んだ点である。
図2を見ると複雑な強度の変動がある。この原因としては、(1)光源の赤外光強度が変動した、(2)試料の厚さが均一でなかった、の二つが考えられる。(1)が原因であれば、試料による特異的な吸収の少ない4000~7000 nm-1の領域の強度で規格化すれば、補正が可能なはずである。そこでこの補正を行った後に、3200~3500 nm-1の吸収の積分値(直線でバックグラウンドを引いたもの)を得てプロットしたのが図3(a)である。図3(a)には若干の構造が見られるが、試料の上方と下方での値の差のほうが大きい。そこで試料の厚さの不均一性を補正する意味で、主として包埋剤のパラフィンに由来する2800~3000 nm-1の吸収ピークの積分値を用いて規格化を行うと、図3(b)が得られた。ここに見られる縞模様の周期は約30ミクロンで、図3(c)の赤外顕微鏡像に見られる弾性板の周期と一致する。したがって、これらの周期構造は大動脈壁の弾性を担っている弾性板の積層構造に由来すると考えられる。

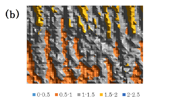

図3 (a)と(b)ヒト大動脈壁のパラフィン包埋病理標本から得られた赤外吸収マッピング像。アパーチャサイズ5ミクロン、5ミクロンピッチで縦200ミクロン、横300ミクロンの領域をマッピングした。試料は大動脈壁の円周接線方向が垂直方向と一致するように置かれている。(a)は3200-3500 cm-1の吸収ピークの積分値(任意尺度)。(b)はそれを2800-3000 cm-1のピークの積分値で規格化した値。(c)は試料の赤外顕微鏡像(縦約350ミクロン、横約450ミクロン)で、マッピングした領域は写真の中央部分である。
図1の吸収スペクトルでは、1000-1800 cm-1の領域に多くの細かな吸収ピークが観察される。これらのピークの中には、エラスチンのランダムコイル構造に由来するピーク[3]やコラーゲンのらせん構造に由来する特徴的なピーク[4]も含まれる。これらのピークの強度を用いてマッピング像を作成したが、何らの特徴的な構造が認められなかった。タンパク質の示す吸収ピークはいずれもアミノ酸に共通な原子間結合の伸縮・変角振動によるもので、タンパク質の種類によって異なるのはその強度比のみである。したがって、複数のタンパク質等が混在する組織標本においては、精製したタンパク質のように各タンパク質に特徴的な吸収スペクトルを得ることが困難なのであろう。
考察:
本研究では、赤外吸収分光マッピングを行うことにより、ヒト大動脈壁において弾性板に由来すると思われる周期的な構造を確認することができた。5ミクロン分解能でのマッピングは放射光FTIRでなければ得られないものである。
得られたマップの解釈には、十分な注意を払う必要がある。図3(b)では弾性板と思われるタンパク質の吸収が観察されるが、ここでは便宜的に試料の厚さの指標としてパラフィンに由来する吸収ピークを用いて補正を行っている。しかし吸収量はランベルト・ベールの法則に従うので、試料の厚みと直線的な関係にはない。例えば試料の厚みが非常に大きく、吸収が1に近い場合には、規格化した値(吸収量の比)は1に近くなる。また、タンパク質が多量に存在する部分ではその分だけ包埋剤のパラフィンの量が少ないことも予想される。これらの理由のため、図3(b)のような規格化を行っても、正しくタンパク質の量を表しているとは限らない。
本実験で用いた試料は支持膜のカプトンから剥がして測定しており、部分的に収縮した可能性がある。また、ミクロトームで切片を切り出した時にも、収縮の可能性がある。弾性板の存在によって切片の硬さは一様でないと考えられるため、収縮が不均一に生じた可能性も否定できない。ただし図2のような大きな強度の違いは、厚さが場所によって7倍程度異ならないと生じない。パラフィン切片がこれほど大きな厚さ不均一性を持つとは考えられず、図2の強度変動には光源赤外光強度の変動も寄与している可能性が大きい。試料の厚みの均一性については、同様の測定を行っている過去の報告では指摘されていない[5]が、不均一な生体組織を扱う場合には重要な問題である。今後の測定においては、まず厚さが一定な試料を得る方法を確立する必要がある。
試料に関する技術的問題が解決されれば、今後の発展として赤外光の偏光を制御することにより、弾性線維やコラーゲン線維の配向を独立に計測できる可能性がある。このような情報は、病理切片写真や蛍光顕微鏡写真と合わせることにより、大動脈壁の力学特性の理解に役立つものと期待される。
参考文献:
[1] Y. Nakashima, J. Jpn. Coll. Angiol. 43, 725 (2003).
[2] Y. Ikemoto, M. Taro, T. Hirono, S. kimura, K. Shinoda, M. Matsunami, N. Nagai, T, Nanba, K.Kobayashi and H. Kimura. Infrared Phys. Tech. 45, 369 (2004).
[3] V. Serrano, W. Liu and S. Franzen. Biophys. J. 93, 2429 (2007).
[4] B. de Campos Vidal and M. L. S. Mello. Micron 42, 283 (2011).
[5] L.-P. Choo, D. L. Wetzel, W. C. Halliday, M. Jackson, S. M. LeVine and H. M. Mantsch. Biophys. J.71, 1672 (1996).
ⒸJASRI
(Received: February 27, 2015; Early edition: April 28, 2015; Accepted: June 29, 2015; Published: July 21, 2015)






