Volume1 No.1
Section B : Industrial Application Report
超小角X線散乱によるインスリンアミロイド線維の構造解析
Structural Analysis of Insulin Amyloid Fibrils as Revealed by Ultra Small Angle X-ray Scattering
a神戸大学大学院理学研究科, b京都大学化学研究所,c京都大学大学院工学研究科
aGrad. Sch. of Sci., Kobe Univ., bInst. for Chem. Res., Kyoto Univ., cGrad. Sch. of Eng., Kyoto Univ.
- Abstract
アミロイド線維は、タンパク質のミスフォールディングにより形成される超分子重合体であるが、様々な疾病に関与するだけではなく、タンパク質凝集の一形態としてタンパク質医薬品の安定性や薬効などにも深く関与する。本研究では、糖尿病のタンパク質製剤として有名なインスリンが形成するアミロイド線維構造を明らかにするため、超小角X線散乱を用いて構造解析を行った。その結果、サブμmオーダーの線維構造の観測に成功し、塩濃度によりこれらの構造が大きく影響を受けることが明らかとなった。
キーワード:タンパク質、アミロイド線維、凝集、階層構造、超小角X線散乱
背景と研究目的:
タンパク質のミスフォールディングにより形成されるアミロイド線維は、アルツハイマー病やクロイツフェルトヤコブ病といったプリオン病等の深刻な疾病に関連すると同時に、タンパク質凝集の一形態として医薬品の安定性にも深く関与している。特に、アミロイド線維のモデル系としてよく用いられるインスリンは容易に線維化しやすく、保存期間中のアミロイド様凝集形成による製剤効力の低下や、インスリンポンプ中の詰まりによる持続投与への障害が産業的な問題として知られている。さらに、凝集物のモルフォロジーの相違により細胞毒性が発現することも報告されており[1]、アミロイド線維の構造特性を理解し制御することは、タンパク質性医薬品の安定且つ安全な創薬において必要不可欠である。しかしながら、アミロイド線維は非常に巨大で水に不溶な重合体であるため、X線結晶構造解析や溶液NMR等の適用が著しく制限されており、形成メカニズムや最終的な立体構造の詳細に関しては現在も十分な解明には至っていない。そのような状況を打開するため、溶液中での形成過程の構造変化を直接追跡できる小角X線散乱(SAXS)測定に注目し、アミロイド線維構造解析を試みた。
最近、我々はNaCl濃度を変化させることで異なる経路を経て線維が形成されることを見出した[2]。そこで、高次構造形成に対する塩効果を詳細に検討するためアミロイド線維に対してBL40B2を用いてSAXS測定を行ったが、SAXSの限られた空間スケールでの解析のみではアミロイド線維の空間階層構造性を十分解明することはできなかった。そこで本研究では、超小角X線散乱(USAXS)測定を行い、SAXS測定と合わせて広い空間スケールを観測範囲にすることで、異なるNaCl濃度で形成されるアミロイド線維の階層構造の解析を行った。
実験:
0〜0.7 MのNaCl濃度存在下において80℃で加熱することにより形成させた5 mg/mlのインスリンアミロイド線維を試料とした。測定はBL19B2を用い、石英を窓材にした2 mm厚のセルに試料を封入した後、波長0.6Å、カメラ長42 m、10分×6サイクルの露光時間の条件で観測を行った。カメラ長の較正には、コラーゲンの653Åの周期(0.0096 Å-1)を用いた。検出器には、高速2次元検出器(PILATUS)を使用した。
結果および考察:
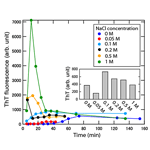
まず、0 Mから0.7 Mまでの様々なNaCl濃度存在下でのインスリンの線維の形成反応を検討した。アミロイド線維と選択的に結合するチオフラビンT(ThT)蛍光分子を用いて励起光445 nm、蛍光485 nmの条件で蛍光強度を追跡したところ、塩濃度に依存して異なる強度の時間発展が見られた。特に、0.2 M以上のNaCl濃度では、以前の測定結果[2]と同様にThT蛍光強度が一時的に著しく上昇し、中間体が過渡的に蓄積することが確認された(Fig.1)。
Fig.1. ThT蛍光強度を用いて追跡したインスリンのアミロイド線維形成反応の塩濃度依存性.図中の棒グラフに最終生成物のThT蛍光強度を示した.
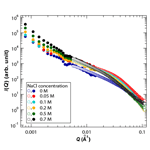
続いてSAXS測定を行った結果、得られた散乱プロファイルは、塩濃度が最終的に得られる線維構造に大きな影響を与えることを示した(Fig.2、open symbols)。小角領域に棒状の形状因子に典型的に見られる−1の傾きが観測されたので、棒状の形状因子を初期モデルとして仮定し、散乱プロファイルのフィッティングを試みた結果、最終的に楕円柱を仮定した形状因子が散乱プロファイルを再現することが明らかとなった。フィッティングから得られた結果によると、長さに関しては塩濃度にほぼ依存せずに800 Å程度の値が得られたが、長軸と短軸の比(aspect比)に関して塩濃度の差を反映した。特に、中間体を経由する高塩濃度側では長軸・短軸のaspect比が5以上であり、中間体を経由しないと考えられる低塩濃度から形成された線維の示す3〜4よりも高い値が得られ、中間体を経由した線維の方がより階層的構造の発達した線維を形成することが分かった。
Fig.2. 様々な塩濃度で形成したアミロイド線維のSAXSおよびUXAXSプロファイル.
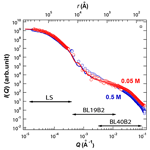
さらに、高次構造形成に対する塩効果をより詳細に明らかにするため、様々な塩濃度条件下で形成されたアミロイド線維のUSAXS測定を行った。得られた散乱プロファイルをFig.2のSAXSの結果に重ねて示した結果(Fig.2, closed symbols)、超小角領域においても塩濃度の相違による高次構造の多様性が示された。特に、高塩濃度で得られたサンプルの方が高い散乱強度を示す傾向が見られ、塩が線維化の高次構造形成の多様性に大きく寄与することが確認された。さらに、低角側にさらなる散乱強度の立ち上がりが見られ、更に大きな空間スケールにおけるアミロイド線維の階層構造の存在が示唆された。そこで、0.05 Mと0.5 MのNaCl存在下で形成したアミロイド線維について、静的光散乱(LS)測定を行った結果、3つの測定結果は比較的良好に繋がり、塩濃度は、波数Qの範囲で10-5~10-1 Å-1という、4桁近い空間スケールにわたり線維構造の階層性の構築に大きな影響を与えることが示された(Fig.3)。
Fig.3. 0.05 Mと0.5 M NaClにおけるSAXS,USAXS,LSを総合したプロファイル.2種類の楕円柱を仮定してフィッティングしたところ、実験データと比較的良い一致が見られた(実線).
2種類の楕円柱を仮定して全Q領域において散乱曲線のフィッティングを試みたが、両塩濃度から作成された線維構造を共に表現することに成功した。この結果から、SAXS領域で観測された楕円柱がいわば”構成要素”となったさらに巨大な線維構造の形成に関与していると考えられる。これまで、アミロイド線維の構造多様性は、クロスβ構造のストランド間構造或いはシート間構造と言った微視的な空間スケールにおいて見出された例が報告されているが、SAXS-USAXS-LS領域の比較的大きな空間スケールにおいても非常に複雑な階層構造が存在することが初めて確認された。
今後の課題:
今回の結果は、USAXS測定がアミロイド線維の立体構造を解析するのに有効であることを示すのと同時に、アミロイド構造制御のパラメーターの1つとして塩濃度が大きく寄与する可能性を明らかにするものであり、将来の生体由来のナノマテリアル材料としてアミロイド線維を用いる観点からも、塩効果が構造制御に役立つことが期待される。さらに、より微視的なクロスβ構造レベルにも着目し、塩濃度による構造多様性が存在するか否かを調べるため、広角X線散乱(WAXS)測定の解析も試みているが、今後、LS、USAXS、SAXS、WAXS の結果を組み合わせることで、階層構造的なアミロイド線維の構造多形を幅広いスケールで詳細に議論することができると期待している。
また、アミロイド線維形成の途中にはオリゴマーやプロトフィブリルのような線維前駆構造と呼ばれる未成熟な構造形態が過渡的に見られることが、これまでのSAXSの解析により明らかにされている[3]。今後、より短時間でUSAXSのシグナル強度を観測できるように試料条件を改善することができれば、USAXSの時間分割測定へと実験を展開することができ、線維前駆体の立体構造が幅広い空間スケールで解明される。インスリンの場合、高塩濃度条件で中間体形成が確認されたが、アミロイド線維の形成過程における構造発展の様子が具体化されれば、中間体がどのように組み込まれて最終的なアミロイド線維構造を構築するのかという詳細な機構についても明確になることが期待される。また、新薬開発においてアミロイド線維形成を高効率で阻害する物質の理論設計が可能となり、さらにはタンパク質製剤の凝集により引き起こされる細胞毒性や免疫原性に対する解決策に対しても飛躍的な進展につながると考えている。
参考文献:
[1] Zako, T. et al., Biophys. J. 96, 3331 (2009).
[2] 茶谷 絵理ら, 第48回日本生物物理学会年会要旨集(2010).
[3] 井上 倫太郎ら, 第49回日本生物物理学会年会要旨集(2011).
©JASRI
(Received: April 4, 2012; Accepted: June 20, 2012; Published: February 28, 2013)