Volume8 No.3
Section B : Industrial Application Report
低原子価コバルト触媒によるC–H結合活性化反応の反応機構研究
Mechanistic Study on C–H Activation Reactions with Low-Valent Cobalt Catalysts
a南洋理工大学, b京都大学
aNanyang Technological University, bKyoto University
- Abstract
-
芳香族炭素−水素(C–H)結合の活性化に触媒活性を有する低原子価コバルト化学種の酸化状態,配位構造等に関する知見を得るべくXAFS解析を行った。コバルト(II) 塩、配位子、有機マグネシウム反応剤から調製される触媒溶液について Co K-edge の XANES および EXAFS 測定を行ったところ、有機マグネシウム反応剤の添加に伴ってコバルトの還元が起こり、最終的に Co(0) または Co(−I) まで還元されることが示唆された。
Keywords:コバルト錯体,均一系触媒反応,XAFS
背景と研究目的:
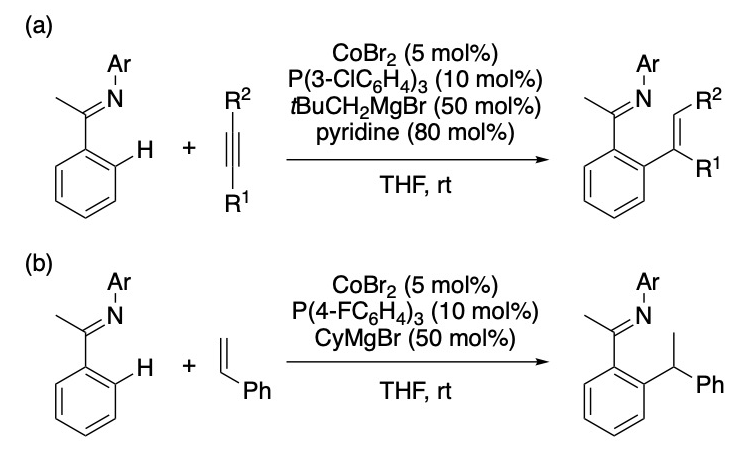
吉戒らの Nanyang Technological University (NTU)グループでは、ロジウム・ルテニウム等の 4d 遷移金属に比べて地殻含有量の高いコバルトを触媒とする炭素−水素(C–H)結合活性化反応の開発に取り組んでおり、これまでにコバルト(II) 塩、ホスフィン配位子、および有機マグネシウム反応剤から調製される低原子価コバルト種を用いた種々の芳香族C–H結合変換反応を報告している[1]。NTUグループではコバルト触媒の反応効率および選択性の向上に資するべく反応機構研究を行っているが、コバルト触媒活性種は一般に常磁性でありかつ酸素、水分、熱に対して不安定であるため、NMR などの一般的分析手法の適用が困難である。一方、高谷・中村らの京大グループは鉄錯体触媒を用いるクロスカップリング反応における常磁性鉄化学種の構造・電子状態を、SPring-8 における放射光を用いたX線吸収微細構造解析(XAFS; X-ray Absorption Fine Structure)により明らかにする中で、常磁性化学種を含む均一系溶液触媒反応の解析手法・技術を蓄積している[2]。以上の背景から、本研究では NTU・京大グループが共同で低原子価コバルト化学種の構造・電子状態を明らかにすることを目的に、コバルト(II) 塩、配位子、有機マグネシウム反応剤の組み合わせからなる触媒系のうち、芳香族イミンのアルキンまたはスチレンへの付加反応を促進するもの(図1)[3,4]について触媒活性種の同定を試みるべく XAFS 測定実験を行った。
図1.本研究で対象としたコバルト触媒 C–H 結合活性化反応:(a)アルキンへの付加[3]、(b)スチレンへの付加[4]
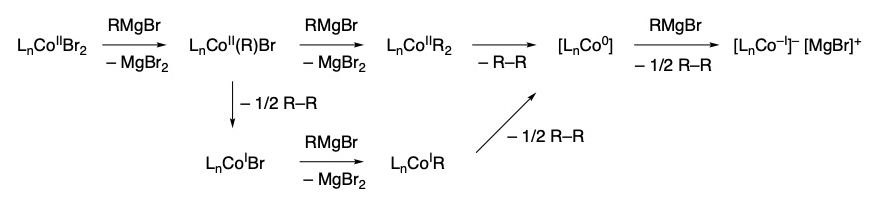
実験に先立って、コバルト(II) 錯体の有機マグネシウム反応剤による還元の経路としては図2に示すものを推定した。コバルト(II) 錯体 LnCoBr2 (L: ホスフィン配位子)と1当量の RMgBr の金属交換によりアルキルコバルト(II) 錯体 LnCo(R)Br が生成する。これがさらに1当量の RMgBr との金属交換によりジアルキルコバルト(II) 錯体を与え、引き続く還元的脱離によりコバルト(0) 錯体を生成する。あるいは、LnCo(R)Br が分子間での金属交換、還元的脱離を起こすことによりコバルト(I) 錯体 LnCoBr を与える経路も考えられる。コバルト(I) 錯体はさらに RMgBr との金属交換、分子間での還元的脱離を経てコバルト(0) 錯体を与える。このコバルト(0)錯体がさらにもう1当量の有機マグネシウム反応剤によって還元されることで、アニオン性コバルト(−I) 錯体を与える経路も考えうる。なお、β-水素を有する有機マグネシウム反応剤が用いられる場合、アルキルコバルト錯体が R-R の還元的脱離ではなく β-水素脱離を経てコバルト(0) 錯体に至るものと考えられる。以上の推定経路に基づくと、Co(II) を Co(0) に還元するには2当量、Co(−I) に還元するには3当量の有機マグネシウム反応剤が理論的に必要となる。
図2.コバルト(II)錯体の有機マグネシウム反応剤による還元の推定経路
実験:
臭化コバルト(CoBr2)、トリアリールホスフィン(P(3-ClC6H4)3 または P(4-FC6H4)3)、および臭化ネオペンチルマグネシウム(tBuCH2MgBr)あるいは臭化シクロヘキシルマグネシウム(CyMgBr)からなる触媒のテトラヒドロフラン(THF)溶液を、BL02B1 付設のグローブボックスを用いてアルゴン雰囲気下のもとで調製した。これを京大グループが開発した 1 mm 厚の石英セル(0.02 mm テフロン窓材)に封入し、BL14B2 ビームラインにてイオンチャンバーを用いた透過法によって Co K-edge (7.709 keV) の XANES および EXAFS 測定を行った。また、一部の試料については Br K-edge (13.5 keV) の測定も行った。なお、試料の調製および測定はすべて室温下で行った。対照実験サンプルとしてコバルトの酸化状態の明確なコバルト箔および CoCl(PPh3)3 の THF 溶液の XAFS 測定をまず行い、引き続いて CoBr2 とホスフィン配位子の 1:2 混合物に有機マグネシウム反応剤を加えて調製した THF 溶液の XAFS 測定を行った。コバルト(II) の還元過程を追跡するため、有機マグネシウム反応剤の当量は1当量、2当量、4当量、10当量と順次変化させたサンプルをそれぞれ調製した。
結果および考察:
図3に CoBr2–P(3-ClC6H4)3–pyridine–tBuCH2MgBr 系(図1aの触媒系)および CoBr2–P(4-FC6H4)3–CyMgBr 系(図1bの触媒系)について得られた XANES スペクトルを示す。いずれの系においても、有機マグネシウム反応剤の添加に伴い、7715 eV 付近の吸収端の低エネルギー側へのシフトが観測された。これはコバルトの酸化数の減少を示唆するものであり、コバルト箔および CoCl(PPh3)3 のスペクトルとの比較から、過剰量の有機マグネシウム反応剤によって生成するコバルト化学種が少なくともI価未満であること、すなわち形式的に0価または−I価の酸化状態を有するものと推定される。注目すべき点として、CoBr2–P(3-ClC6H4)3–pyridine–tBuCH2MgBr 系においては、有機マグネシウム反応剤を4当量から10当量とした段階でもスペクトルの顕著な変化が見られた一方、CoBr2–P(4-FC6H4)3–CyMgBr 系については、同じ段階で必ずしも明確な変化は見られなかった。このことは、有機マグネシウム反応剤の有機基の種類、このケースでは具体的には β-水素の有無(tBuCH2:β水素なし、Cy:β水素あり)によって還元能が異なることを反映したものではないかと推測される。
図3.(a) CoBr2–P(3-ClC6H4)3–pyridine–tBuCH2MgBr 系の XANES スペクトル
(b) CoBr2–P(4-FC6H4)3–CyMgBr 系の XANES スペクトル
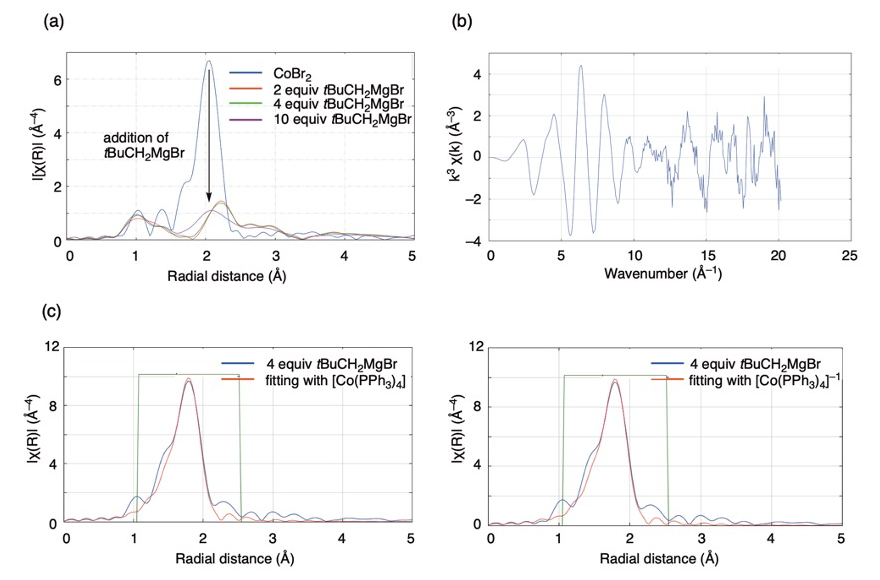
さらに、CoBr2/P(3-ClC6H4)3/pyridine/t-BuCH2MgBr 系の Br K-edge EXAFS スペクトルから導出した Br 原子周りの動径構造関数において、有機マグネシウム反応剤の添加に伴って顕著な変化が観測された(図4a)。すなわち、CoBr2 において明確に見られた Co–Br 結合のピークが消失し、コバルト周辺の配位構造が大きく変化していることが示唆された。また、同系の Co K-edge EXAFS スペクトル(図4b)から導出した Co 原子周りの動径構造関数について、DFT 計算(B3LYP/LAND2DZ for Co, 6-31G(d) for C, H, P)によって構造最適化したコバルト錯体(計算時間の短縮のため P(3-ClC6H4)3 を PPh3 に置換)によるフィッティングを試みた(図4c)。その結果、いずれも4面体構造をとる0価4配位錯体 [Co(PPh3)4] および −I 価4配位錯体 [Co(PPh3)4]−1 について同程度の一致が見られた(R 値はそれぞれ 4.89%、4.93%)。したがって、これらのフィッテイングによる酸化状態の一義的な決定は困難であるものの、図2に示した推定経路を経ていわゆるホモレプティックな低原子価コバルト種が生成していることが示唆される。なお、Co(0) あるいは Co(−I) 化学種が上記の C–H 結合活性化、特にアルキンのヒドロアリール化の触媒となることは、最近の他のグループによる構造の明確なコバルト−単座ホスフィン錯体を用いた検討によっても明らかにされている[6,7]。
図4.CoBr2–P(3-ClC6H4)3–pyridine–tBuCH2MgBr 系の (a) Br 原子周辺の動径構造関数、
(b) Co K-edge EXAFS スペクトルおよび (c) Co 原子周辺の動径構造関数とその
[Co(PPh3)4]n (n = 0 or −1)によるフィッティング(k-range: 2 to 14)
今後の課題:
上記の測定およびフィッティングの結果からホモレプティックな低原子価コバルト種、すなわち [Co(PAr3)4] あるいは [Co(PAr3)4]−1 に相当する化学種が生成していることが示唆されたものの、コバルト箔とコバルト錯体の電子状態の相違もあるため、今回の結果のみからコバルトの酸化状態を明確に決定することは困難と考えられる。ホモレプティックな0価コバルト−単座ホスフィン錯体としては [Co(PMe3)4] が知られているものの[8]、同様のトリアリールホスフィン型錯体は知られていない。−I価 コバルトホスフィン錯体としては[Co(PPh3)3(N2)][Li(THF)3] や [Co(PPh3)3(N2)]2[Mg(THF)4] が知られている[9]。これらを含めた既知の Co(0) および Co(−I) 錯体を用いて比較検討することによって、系中で発生させたコバルト種の電子状態についてさらに確かな知見が得られものと考えられる。また、今回の検討では ex situ 測定におけるサンプル調製から測定までの一連の作業手順に当初の予測より時間がかかり、計画していたフローセルでの測定まで進むことができなかったことも今後の課題として残る。一方で、上記の測定結果に発想を得て、有機マグネシウム反応剤に依らずに触媒活性のある低原子価コバルト種を調製する方法も見出している[10]。これについても今後の XASF解析により触媒活性種の詳細を明らかにしたいと考えている。
参考文献:
[1] K. Gao, N. Yoshikai, Acc. Chem. Res., 47, 1208 (2014).
[2] H. Takaya et al., Bull. Chem. Soc. Jpn., 88, 410 (2015).
[3] P.-S. Lee, T. Fujita, N. Yoshikai, J. Am. Chem. Soc., 133, 17283 (2011).
[4] J. Dong, P.-S. Lee, N. Yoshikai, Chem. Lett., 42, 1140 (2013).
[5] K. Gao, N. Yoshikai, Angew. Chem. Int. Ed., 50, 6888 (2011).
[6] B. J. Fallon et al., J. Am. Chem. Soc., 137, 2448, (2015).
[7] B. A. Suslick, T. D. Tilley, J. Am. Chem. Soc., 142, 11203 (2020).
[8] H.-F. Klein, H. H. Karsch, Chem. Ber., 108, 944 (1975).
[9] A. Yamamoto et al., Organometallics, 2, 1429 (1983).
[10] W. Xu, J. H. Pek, N. Yoshikai, Adv. Synth. Catal., 358, 2564 (2016).
(Received: March 28, 2020; Accepted: October 23, 2020; Published: October 29, 2020)