Volume8 No.3
SPring-8 Section A: Scientific Research Report
多様化したDEAD-box helicaseであるUAP56ならびにURH49の選択的mRNA核外輸送能を支える複合体形成能と立体構造の相関解析
The Correlation of Structures, Complex Formations, Selective mRNA Export Activities in UAP56 and URH49, which are Diversified mRNA Exporters
京都大学
Kyoto University
- Abstract
-
ヒトにおいて mRNA の核外輸送に働く mRNA 輸送因子 UAP56 と相同性の高いパラログ URH49 は、Apo-TREX および Apo-AREX 複合体の形成と、ATP 結合による ATP-TREX 複合体の形成を介して選択的 mRNA 輸送に働く。両者の複合体形成基盤の解明を目的として、UAP56、URH49 ならびに複合体形成制御領域を置換した変異体について ATP 非存在 / 存在下の SAXS 解析を行った。結果、ATP 非存在化において UAP56 と URH49 の溶液中構造に差異が存在し、ATP 存在化では両者の構造が相同になるというユニークな複合体形成の制御機構の可能性が示唆された。
Keywords:UAP56、URH49、ATP、複合体形成機構
背景と研究目的:
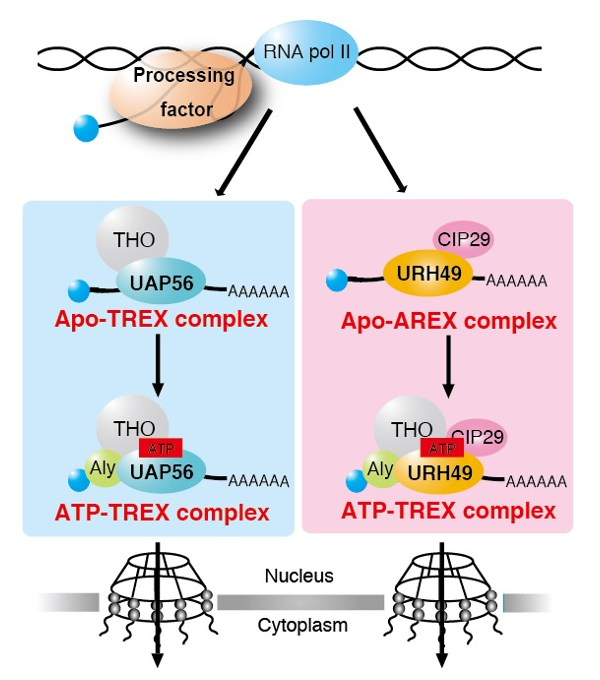
真核生物の遺伝子発現において核内で前駆体 mRNA が転写され、その後プロセシングを受けて成熟した mRNA は核外へと輸送される[1]。この核外輸送において UAP56 と相同性の高いパラログ URH49 はそれぞれの複合体構成因子と結合して異なる Apo-TREX および Apo-AREX 複合体を形成する[2]。その後、ATP が結合することで両者はそれぞれ独立して ATP-TREX 複合体を形成する[3]。UAP56 と URH49 はこの複合体形成を介して異なる mRNA 群の輸送に機能することで、ゲノムワイドな遺伝子発現制御に働くことを私たちは明らかにしてきた[2-3](図1)。続いてこれまでの解析から UAP56 と URH49 において複合体形成能を制御する領域を同定した(未公表)。トリプシンと各精製タンパク質を用いた限定分解の解析から、ATP 非存在化では UAP56 と URH49 において立体構造の違いが存在し、複合体制御領域がその違いを規定すること、ATP 存在化では UAP56 と URH49 の立体構造が相同になることが示唆された。UAP56 については既に結晶構造が報告されている一方で URH49 については明らかではなかった[4]。そこで URH49、および複合体制御領域を UAP56 型に置換した URH49 変異体の結晶構造解析を行った。その結果、URH49 について UAP56 の結晶構造と違いが観察されたが、URH49 の結晶構造には ATP 結合部位に結晶化剤に含まれる PO4 が配位しており Apo 型ではなく ATP 結合型の立体構造を反映している可能性が考えられた(未公表)。同様に URH49 変異体についても ATP 結合部位に PO4 が配位しており URH49 と同様の立体構造であった。よって溶液中の構造を解析できる SAXS 解析によって Apo 型 / ATP 結合下の UAP56 と URH49、ならびに複合体形成制御領域を置換した変異体の立体構造を解析することで、両者の立体構造差異に基づく複合体形成基盤の解明を試みた。
図1:UAP56 と URH49 による選択的 mRNA 輸送機構
実験:
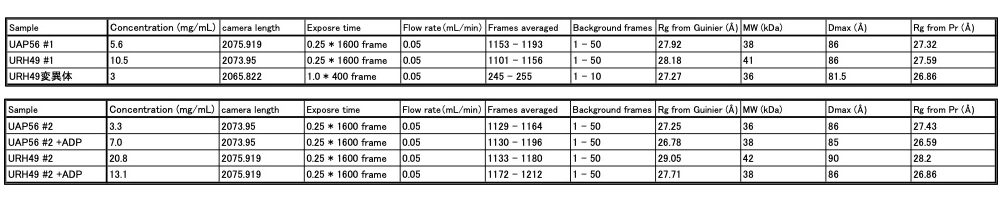
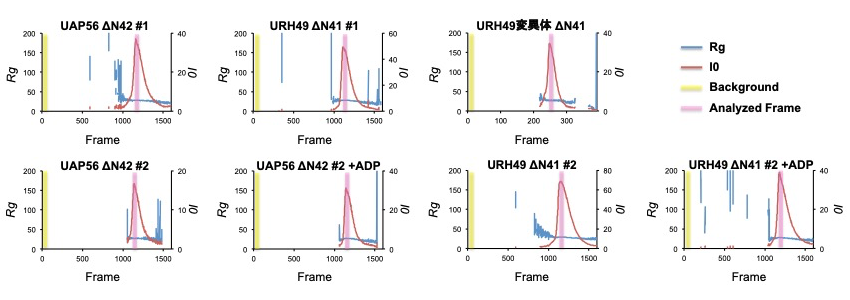
上記のトリプシン限定分解・X線結晶構造解析に使用したものと同様の UAP56 と URH49、およびその変異体の精製タンパク質を実験に用いた(以降、UAP56ΔN、URH49ΔN、URH49 変異体 ΔN と記載する)。これらの試料について BL45XU SAXS station にて、Superdex200 Increase 3.2/300(GE Healthcare 社)カラムを用いたゲル濾過クロマトグラフィーとX線測定装置を直結させた SEC-SAXS 解析を行った。様々な濃度の UAP56、URH49 および変異体試料について解析を行い、単分散なピークのシグナルを得た。ATP のアナログとして ADP を、各精製タンパク質に終濃度 5mM になるよう加え 4℃ でインキュベートし、ADP 結合各タンパク質溶液とした。この溶液を同じく ADP を加えたバッファーで SEC-SAXS 解析し、UAP56 と URH49 の ADP 結合型のピークシグナルを得た。各データから散乱強度の高い点を選出し、プログラム SCATTER[5] を用いて各データ間の比較解析を行った。各サンプルにおける SEC-SAXS 解析条件と解析に用いたデータフレーム、および得られた Rg、Dmax 値について表1に示す。SEC-SAXS の溶出プロファイルを図2に示す。
表1:各サンプルにおける SEC-SAXS 条件および解析により得られた Rg、Dmax 値
図2:各サンプルの SEC-SAXS の溶出プロファイル
結果と考察
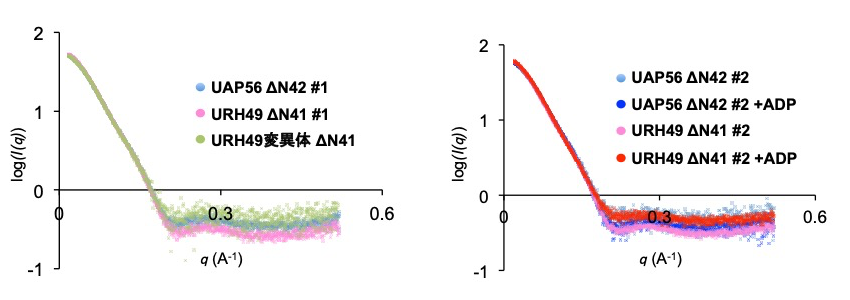
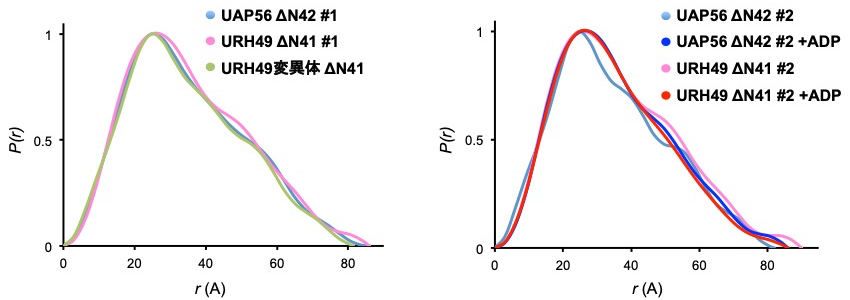
まず SEC-SAXS 解析による実測散乱曲線の比較を行った(図3)。UAP56ΔN、URH49ΔN、URH49 変異体 ΔN のそれぞれについて、大きな違いは観察されなかった。この傾向は ADP を加えたものにおいても同様であった。Guinier 解析によって求められた慣性半径(Rg)からも各サンプル間での顕著な違いは見出せなかったが ADP を加えることでそれぞれ若干減少する傾向が観察された(表1)。UAP56 と URH49 が属する DEAD-box 型 helicase ファミリーのタンパク質は N 側と C 側の2つのドメイン構造を有しており、ATP 非結合状態では各ドメインが離れたオープン構造を、ATP 結合状態では近接したクローズド構造を示す[6]。ADP 添加による Rg 値の減少はこれを反映した可能性が考えられた。続いて UAP56ΔN と URH49ΔN の P(r) 曲線の違いを観察した。UAP56ΔN とU RH49ΔN の P(r) 曲線には違いが観察され、複合体形成制御領域を UAP56 型にした URH49 変異体 ΔN は、UAP56ΔN と相同な P(r) 曲線を示した(図4左)。このことから、UAP56ΔN と URH49ΔN の溶液中構造に差異が存在し、複合体形成制御領域の違いが溶液中構造差異を規定することが示唆された。続いて ADP を加えた条件においては UAP56ΔN と URH49ΔN が、それぞれ相同な P(r) 曲線を示した(図4右)。またこの P(r) 曲線は AD P非存在化で観察されたものとも異なっていた。これらのことから、UAP56 と URH49 はアポ型において複合体形成制御領域の違いによって異なる立体構造をとること、加えて ATP 結合型において両者はアポ型と異なった、相同な立体構造をとることを支持する結果が得られた。
図3:各サンプルの実測散乱曲線の比較
図4:各サンプルの P(r) 曲線の比較
今後の課題:
本研究におけるデータ測定は SPring-8 BL45XU(課題番号:2017A1111、2017B1097)で行いました。また SCATTER によるデータ解析は Diamond Light Source の井上勝晶博士に行っていただきました。BL45XU ビームラインスタッフの皆様、井上勝晶博士に感謝致します。
参考文献:
[1] S. Masuda et al., Genes Dev., 19, 1512-1517, (2005).
[2] T. Yamazaki et al., Mol. Biol. Cell, 21, 2953-2965, (2010).
[3] K. Fujita et al., BBA - Gene Regulatory Mechanisms, 1863, 194480, (2020).
[4] H. Shi et al., PNAS, 101, 17628-17633, (2004).
[5] R. Rambo, J. Tainer., Nature, 496, 477-481, (2013).
[6] S. Ozgur et al., FEBS Journal, 282, 850-863, (2015).
(Received: April 7, 2020; Accepeted: October 23, 2020; Published: October 29, 2020)