Volume8 No.3
SPring-8 Section A: Scientific Research Report
副甲状腺ホルモン PTH は軟骨内骨化の必須条件である破軟骨細胞による石灰化軟骨吸収作用を抑制する
Parathyroid Hormone PTH Suppresses the Resorption of Calcified Cartilage by Osteoclasts, a Prerequisite for Endochondral Ossification
aラトックシステムエンジニアリング株式会社, b東北大学多元物質科学研究所, c慶應義塾大学医学部細胞組織学研究室
aRatoc System Engineering Co., Ltd., bInstitute of Multidisciplinary Research for Advanced Materials, Tohoku University, cLaboratory of Cell and Tissue Biology, Keio University School of Medicine
- Abstract
-
骨粗鬆症治療薬である副甲状腺ホルモン PTH は、骨吸収や骨形成を促進することが知られている。しかし、連続投与すると骨吸収促進作用があるとされている。本実験では、成長板直下における軟骨小腔や一次海綿骨の石灰化を反映した3次元画像を取得して解析し、その機序の解析を試みた。PTH 非投与群では、肥大軟骨小腔の横中隔基質と縦中隔基質が吸収され、血管と骨髄が軟骨小腔に侵入し、石灰化肥大軟骨は吸収され、一次海綿骨が形成された。この経過は軟骨内骨化における不可欠の過程である。一方、PTH 連続投与群では、横中隔基質が石灰化し、肥大軟骨小腔が残存し、内部は低石灰化骨で満たされた。横中隔基質の石灰化により血管が侵入できず、破骨細胞が形成されない結果、骨吸収が抑制された。石灰化軟骨が一部残存し肥大軟骨小腔に低石灰化骨が形成され、石灰化骨への置換に障害をきたした。
Keywords:骨粗鬆症治療薬、副甲状腺ホルモン PTH、肥大軟骨小腔、骨吸収、骨形成、マルチスキャンX線顕微鏡、微分位相コントラスト法、デフォーカス位相コントラスト法
背景と研究目的:
副甲状腺ホルモン PTH は投与後一日で血中から消失する。血中濃度が低下する期間を設ける間欠投与を行うと、骨形成が促進されて骨量増加をもたらす。間欠投与法は骨形成促進薬としてその有効性が高く、臨床で使用されている。PTH の骨形成促進作用は、前骨芽細胞の分化を促進することによる[1]。一方 PTH の血中濃度を維持する連続投与を行うと、骨吸収が促進され骨粗鬆化を引き起こす。我々は、SPring-8 を利用することにより、破骨細胞による骨吸収作用とは独立に、骨細胞が骨ミネラルを溶解し血中のカルシウム濃度を上昇させる作用を持つことを明らかにした[2]。さらに 2013B1425 の実験において、PTH を連続投与すると、骨幹における骨吸収促進とは正反対に成長板直下では骨吸収抑制の活性を示すことを見出した。骨吸収抑制作用については不明な点が多い。そこで、この作用の詳細を検討することとした。具体的には、マウスに PTH 製剤を血中濃度を維持するように連続的に投与し続け、成長板直下における石灰化骨の形成と吸収を調べた。破骨細胞の活性をコントロールする条件を明らかにすることを目的とした。
実験:
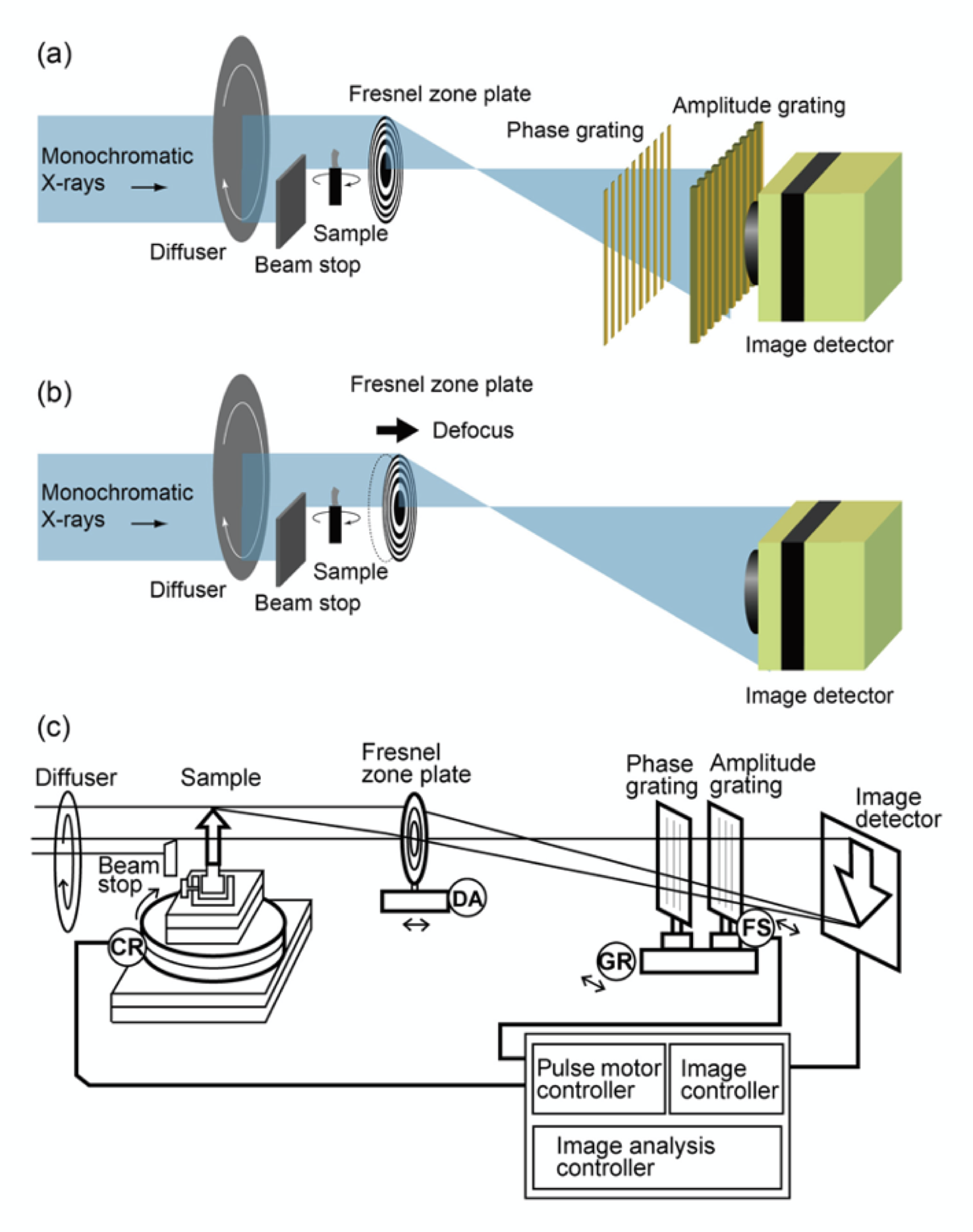
BL20XU にゾーンプレートと Talbot 干渉計を組み合わせたマルチスキャンX線顕微鏡[3]を組み上げ、骨片の同一部位を微分位相コントラスト法とデフォーカス位相コントラスト法で試料を回転させて CT スキャンし、ボクセルサイズ 0.2 μm の 3D 像を得た。
[微分位相コントラスト法]
X線顕微鏡において、フレネルゾーンプレートを用いた倍率約 20 倍の結像顕微鏡を構築し、試料はオンフォーカス面とし、画像検出器前面に Talbot 干渉計[4]を配置して微分位相画像を得られるようにする (図1 (a))。
[デフォーカス位相コントラスト法]
試料はフォーカス面より数 mm ずらすことによりデフォーカス条件を得る (図1 (b))。これにより、輪郭強調コントラストを発生させる[5]。
図1.実験方法 (a) 微分位相コントラスト (b) デフォーカス位相コントラスト
(c) マルチスキャンX線顕微鏡 駆動部
CR:CT撮影用回転モーター
DA:レンズフォーカスオフセット用モーター
GR,FS:グレーティング移動モーター
微分位相観察のとき光路に設置
デフォーカス位相観察のとき除去
微分位相コントラスト法はX線に対する物体の位相のシフト量が吸収法より 100倍 以上大きな値を持ち、物質濃度差を感度良く検出できる。肥大軟骨細胞が識別可能である。デフォーカス位相コントラスト法は吸収コントラストであるが、デフォーカス効果によりの組織のエッジが強調され、解像度より微細な構造を描画できる。骨細管が描画可能。マルチスキャンX線顕微鏡は、両者の特徴を利用し骨細胞、骨石灰化の定量、骨内細胞の識別が可能である (図1)。
サンプル:7-週齢マウス脛骨
① PTH 非投与群 (n=4)
② PTH 連続投与群 (n=4)
マウス皮下に浸透圧ポンプを装着し、PTH を血中濃度がゼロとならないように連続的に注入し続ける方法で投与し、PTH の血中濃度を維持した。投与前、144 時間経過後脛骨を摘出した。成長板を縦断する 300 μm 角の骨片を作成し(図2)、SPring-8 のマルチスキャンX線顕微鏡で CT スキャンした。
図2.SPring-8用サンプル
7W マウス脛骨の成長板を含む、一次海綿骨を垂直方向に 300 μm 角柱にカットした
結果および考察:
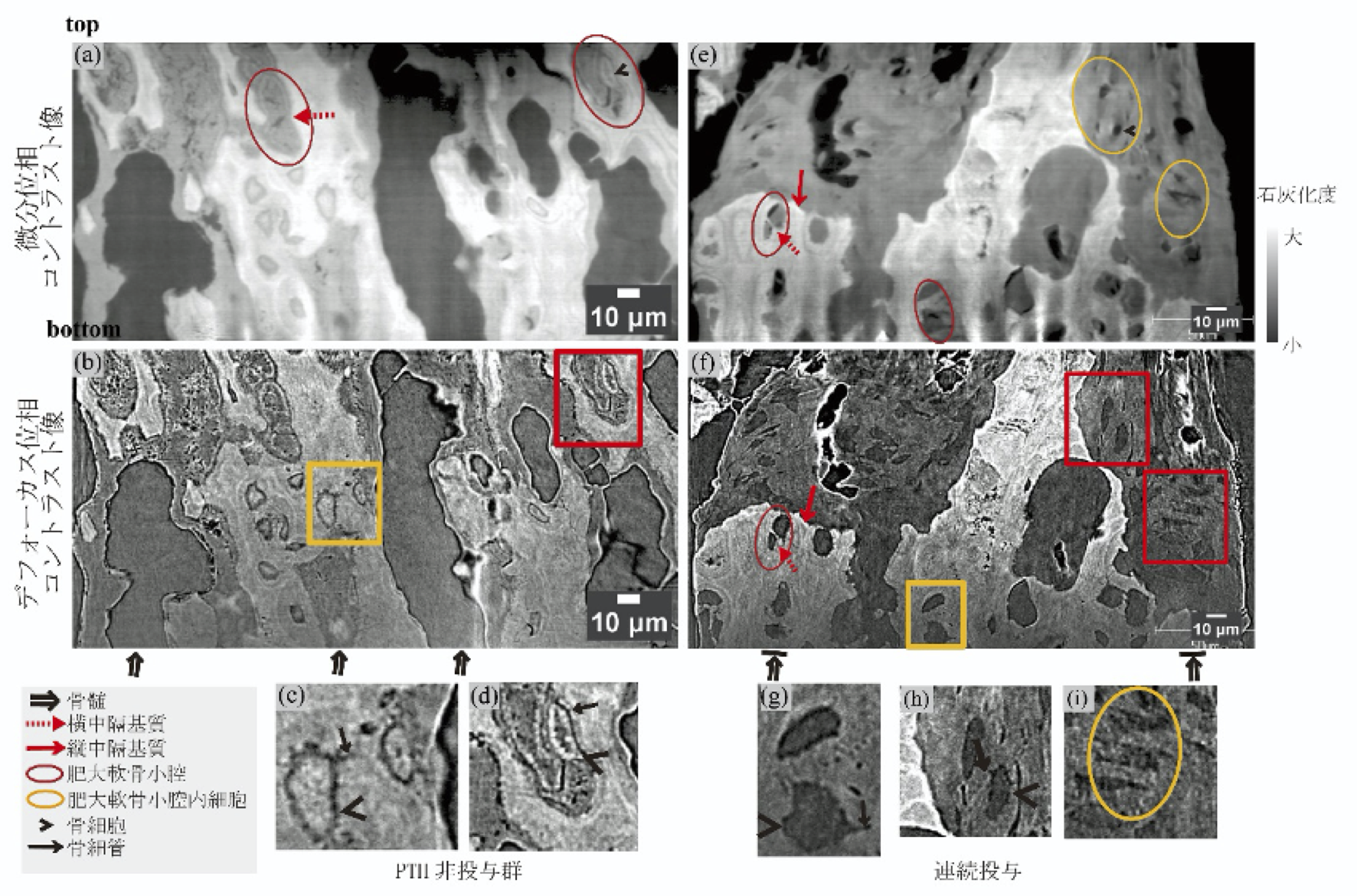
PTH 非投与群では、骨幹側(図3 (a) (b) の下)から成長板軟骨側(図3 (a) (b) の上)に向けて、骨髄の侵入(⇒)が顕著に見られた。軟骨側のペアをなす肥大軟骨(図3 (a)、赤丸)直下まで骨髄が侵入していた。石灰化部位にペアをなす肥大軟骨小腔は描画されておらず代わりに、骨細管(→)を持つ、骨細胞(>)が、随所に存在した(図3 (b) 黄四角、拡大像 (c))。軟骨側の肥大軟骨小腔内にも骨細胞が存在した(図3 (b) 赤四角、拡大像 (d))。肥大軟骨小腔を隔てる、横中隔基質は石灰化せず残っていた(図3 (a) 赤丸内、赤破線矢印)。
図3.SPring-8 における CT 実験結果:
(a, e) 微分位相コントラスト像、(b, f) デフォーカス位相コントラスト像、
(c, g) 黄枠 (b, f) の拡大像、(d, h, i) 赤枠 (b, f) の拡大像
微分位相コントラスト像は骨の石灰化度を示す(白は大、灰は小)
連続投与群においては骨幹側(図3 (e))の高石灰化部位に、石灰化肥大軟骨小腔のペアを成す構造が残っていた(図3 (e) 赤丸内、赤破線矢印)。この部位には骨幹側からの骨髄の侵入を認めなかった。骨髄が未侵入であった石灰化部位(図3 (e) 赤矢印)に隣接して骨細胞(>)が形成されていた(図3 (f) 黄四角、拡大図 (g))。成長板軟骨側には骨髄をともなわない低石灰化部位が広範囲に存在した(図3 (e) 黄丸)。低石灰化部位内には小腔内に骨細管(図3 (f) 赤四角、拡大像 (h) → )を持つ骨細胞が存在しており(拡大図 (h) < )、低石灰化部は骨組織であることを示唆している。さらに骨芽細胞前駆細胞様の細胞が存在した(図3 (i) 黄丸下)。デフォーカス像においても、骨髄の侵入が抑制された骨幹側高石灰化部位(図3 (f) ⇒|)においては、肥大軟骨小腔のペア形状が軟骨の原形を残していることが確認できた(図3 (f) 赤丸、黄四角)。
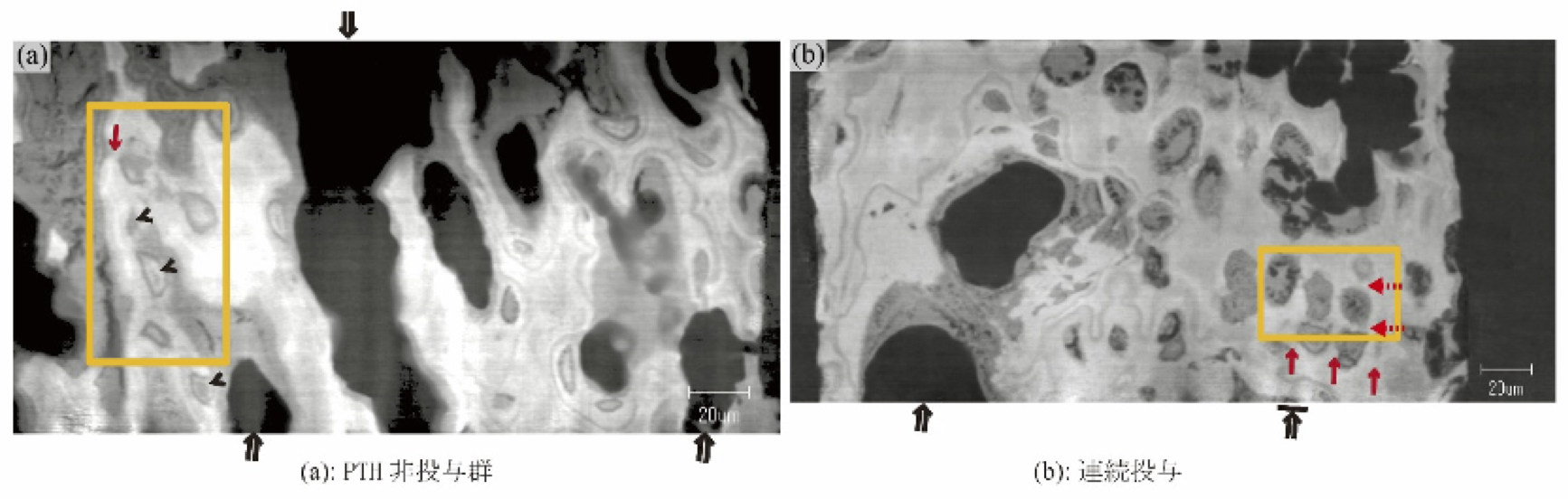
非投与群の縦中隔基質は、石灰化し、残存した。縦中隔基質(赤→)にそって、骨(>)が形成された (図4 (a) 黄四角) 。連続投与群において、ペア肥大軟骨小腔に接する横中隔基質(赤点線矢印)、縦中隔基質(赤→)とも石灰化し、残存した(図4 (b))。
図4.SPring-8 における微分位相CT実験結果(スケールバー:20 μm)
PTH の非投与群においては肥大軟骨小腔内に骨細胞が形成され肥大軟骨小腔のペア形状は消失していたことから、石灰化肥大軟骨小腔への血管侵入、軟骨基質の吸収、骨形成が進んだものと考えられた。肥大軟骨小腔の石灰化した縦中隔基質にそって骨細胞が整列しており、縦中隔基質は軟骨内骨化において初期海綿骨形成における足場を提供していると推察された。さらに、非投与群は成長板直下において、石灰化軟骨が骨へ置換される過程を示した。
これに対し連続投与群においては、骨幹側石灰化部位において肥大軟骨基質のペア形状が残存したことから骨髄の侵入が抑制されていると考えられた。石灰化肥大軟骨小腔の横中隔基質は石灰化しており、血管の侵入が防止されたと考えられた。その結果、破軟骨細胞が形成されず、骨髄の侵入が抑制され石灰化軟骨基質が温存されたと考えられる。一方、軟骨側では、肥大軟骨形状を残しながら、骨髄の進入のない状態で骨細胞の存在する低石灰化骨が広範囲に広がって存在した。このことは肥大軟骨の石灰化を経ずに肥大軟骨細胞が骨芽細胞に分化し、肥大軟骨小腔内に骨形成が行われた可能性を示唆する。低石灰化部内には骨芽細胞前駆細胞様の形態を認めた(黄丸下)。 PTH 連続投与群においては PTH の過剰な存在が、PTHrP 陽性細胞を活性化させ肥大軟骨細胞の石灰化を抑制し、骨芽細胞前駆細胞、骨芽細胞への分化を促進させた可能性を示唆した。
今後の課題:
1. PTH 連続投与群の低石灰化骨の存在は肥大軟骨細胞が骨芽細胞へ分化した可能性を示した。
この現象が起きているのか、PTH連続投与で促進されたのか追加の実験が望まれる。
2. PTH 連続投与による肥大軟骨細胞吸収の抑制は、血管未侵入による破軟骨細胞未形成との因果関係が考えられた。血管未侵入と横中隔基質の石灰化は原因と結果がどちらであるか不明である。
3. PTH 連続投与群において血管の肥大軟骨への進入の遅れが観察された。本現象は軟骨がもたらしているのか、血管側の要因によるのか、調査が必要である。
4. 観察している骨への置換遅延現象の経時変化を調査するために成長板軟骨から二次海綿骨に至る長さ数 mm の範囲を連続的にスキャンすること、および,成長板に隣接する皮質骨をスキャンすることが必要である。
参考文献:
[1] T. Hasegawa et al.: Folia Pharmacol. Jpn., 153, 16 (2019).
[2] N. Nango et al.: Bone, 84, 279 (2016).
[3] N. Nango et al.: Biomed. Opt. Express, 4, 917 (2013).
[4] A. Momose et al.: Jpn. J. Appl. Phys., 42, L866 (2003).
[5] A. Snigirev et al.: Rev. Sci. Instrum., 66, 5486 (1995).
(Received: March 26, 2020; Accepted: October 23, 2020; Published: October 29, 2020)