Volume8 No.2
SPring-8 Section A: Scientific Research Report
[NiFe]ヒドロゲナーゼ活性部位における酸素の影響
Influence of Oxygen at the Active Site in [NiFe] Hydrogenase
兵庫県立大学 大学院生命理学研究科
Graduate School of Life Science, University of Hyogo
- Abstract
-
[NiFe]ヒドロゲナーゼは一般的に酸素によって失活するが、近年、酸素に対して耐性を持つものが見つかってきている。これまで[NiFe]ヒドロゲナーゼの酸素に対する反応性の違いは、鉄硫黄クラスターの構造変化の違いにのみ注目して説明されることがほとんどであったが、Desulfovibrio vulgaris Miyazaki F 株(DvMF)由来の標準型[NiFe]ヒドロゲナーゼに関して、酵素が酸素に曝された際に、活性部位を構成する Ni 原子の占有率が低下することが報告された。本研究では、酸素と反応した際の[NiFe]ヒドロゲナーゼの活性部位での構造変化についてさらに詳しく調べることを目指した。
Keywords: [NiFe] ヒドロゲナーゼ,Ni-Fe 活性部位
背景と研究目的:
ヒドロゲナーゼは、金属錯体を活性部位に持つ金属酵素で、可逆的な水素の分解・合成反応を触媒する。ヒドロゲナーゼは、活性中心を構成する金属原子の種類によって[NiFe]ヒドロゲナーゼ、[FeFe]ヒドロゲナーゼ、[Fe]ヒドロゲナーゼの3種類に大別される。多くのヒドロゲナーゼは嫌気環境で働いており、酸素によって失活してしまうものがほとんどであるが、[NiFe]ヒドロゲナーゼの中には、酸素存在下でも触媒能を示すものが見つかってきている。
Hydrogenovibrio marinus 由来の酸素耐性[NiFe]ヒドロゲナーゼでは、これまでに水素還元型(PDB ID:3AYX)、空気酸化型(PDB ID:3AYZ)、フェリシアン化カリウム強制酸化型(PDB ID:5Y34)の結晶構造が、また酸素耐性を有さない Desulfovibrio vulgaris Miyazaki F 株(DvMF)由来の標準型[NiFe]ヒドロゲナーゼでは、還元型(PDB ID:4U9H)、空気酸化型(PDB ID: 1WUK)の結晶構造がそれぞれ決定されており、酸素耐性を有する[NiFe]ヒドロゲナーゼでは[4Fe-3S]-6Cys 型近位鉄硫黄クラスターを持ち、この特異な鉄硫黄クラスターが酸化還元に伴い構造変化することが酸素耐性獲得に重要であることが報告されている[1]。また、近年発見された Citrobacter sp.S-77(S-77)由来膜結合ヒドロゲナーゼは酸素安定性および高触媒活性を有するが、S-77 は酸素耐性を有さない標準型と同様に[4Fe-4S]-4Cys 型の鉄硫黄クラスターであり、[4Fe-3S]-6Cys モチーフは保存されていなかったため新たな酸素耐性の仕組みを持っていることが報告されている[2]。
最近、筆者らは DvMF 由来の標準型[NiFe]ヒドロゲナーゼに関して、酵素が酸素に曝された際に、活性部位を構成する Ni 原子の占有率が低下することを見出した[3]。これまで[NiFe]ヒドロゲナーゼの酸素に対する反応性の違いは、鉄硫黄クラスターの構造変化の違いにのみ注目して説明されることがほとんどであった。そこで本研究では、嫌気的に調製した還元型結晶を酸素 100% 雰囲気に暴露させることにより、酸素と反応した際の[NiFe]ヒドロゲナーゼの活性部位での構造変化についてさらに詳しく調べることを目指した。
実験:
DvMF 由来標準型[NiFe]ヒドロゲナーゼの還元型結晶は文献[4]の方法に従い作製した。すべての精製操作をグローブボックス内で嫌気的に行い最終精製標品を得た。結晶化はシッティングドロップ蒸気拡散法を用いて行った。0.29 mM ヒドロゲナーゼ、25 mM Tris-HCl (pH7.4)、30% 2-methyl-2,4-pentanediol (MPD)となるように混合した結晶化母液に種結晶をシードし、これを 25 mM Tris-HCl (pH7.4)、40% MPD に対して蒸気平衡させた。結晶化プレートを 10 ºC に静置し結晶成長させた。結晶析出後、結晶化プレートをガス不透過フィルム(バリア三方袋 KC-3-12、フィルム厚:0.06mm、フィルム構成:KOP20/ドライラミ/CPP40)でパックし、パック内の気相を 100% 窒素ガスで置換し 10 ºC で 24 時間静置した。
酸素酸化型結晶は、還元型結晶を調製した後、結晶化プレートをガス不透過フィルムでパックし、パック内の気相を 100% 酸素ガスで置換し 10 ºC で 24 時間静置することで調製した。
調製した還元型結晶および酸素酸化型結晶は、窒素ガスで満たしたグローブボックス内で低温窒素気流により凍結し、測定まで液体窒素中で保管した。
還元型、酸素酸化型結晶のそれぞれについて、BL44XU において窒素気流によって 100 K に冷却し波長 0.9 Å のX線で回折実験を行った。また、酸素酸化型については、異常分散効果を利用して Ni の位置を同定するため、波長 1.48 Å および 1.49Å のX線で回折実験を行った。収集したデータセットは XDS Package[5]を用いてデータプロッセッシング、データマージング、データスケーリングを行った。その後、既知の還元型構造 (PDB ID: 4U9H, 0.89Å) をサーチモデルとして、Phaser[6]を用いて分子置換を行い初期位相を計算した。モデルの構築・修正と構造精密化はそれぞれ Coot[7]と REFMAC5[8]により行った。
結果および考察:
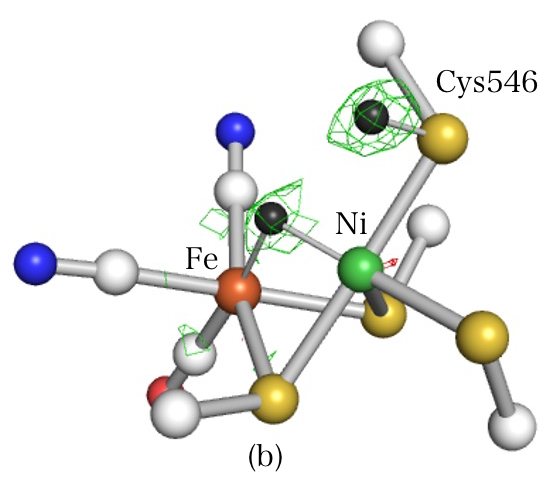
還元型結晶からの回折データセットは 1.06 Å 分解能で収集され、還元型の構造解析を行ったところ Rwork / Rfree (%)はそれぞれ 11.9 / 12.7 で精密化された。結晶学的統計値を表1にまとめた。還元型の活性部位の構造を図1(a)に示した。Fe と Ni 原子の間には酸素による架橋は存在せず典型的な還元型の構造であった。図1(b)には PDB ID:4U9H の活性部位を示した。4U9H は Ni-R と呼ばれる最還元型の状態であり水素が存在する雰囲気下で調製されたものである。Fe と Ni 原子の間はヒドリドが架橋し、また Cys546 の Sγ 原子はプロトン化されており、水素原子が存在する場所では正の Fo-Fc 差電子密度ピークがそれぞれ存在している。一方、本実験で調製した還元型は、100% 窒素雰囲気下で調製されたものであるが、4U9H ではヒドリド架橋配位子が存在していた位置に正の Fo-Fc 差電子密度ピークが確認された。Cys546 の Sγ 原子周辺には Fo-Fc 差電子密度のピークは確認されなかった。分光学的実験により、本酵素は、窒素雰囲気下では主として Ni-C という状態を取ることが報告されているが[9]、Ni-C では Fe と Ni の間にヒドリドが架橋していると予想されている。本研究で得られた還元型の活性部位の構造は,Ni-C に相当する構造であると考えられた。
| 還元型 | 酸素酸化型 | |||
| Data collection | ||||
| Beam source | BL44XU | BL44XU | BL44XU | BL44XU |
| Wave length (Å) | 0.90000 | 0.90000 | 1.48000 | 1.48000 |
| Oscillation (°) | 0.50 | 0.50 | 0.50 | 0.50 |
| Temperature (K) | 100 | 100 | 100 | 100 |
| Space group | P212121 | P212121 | P212121 | P212121 |
| Unit cell parameters | ||||
| a, b, c (Å) | 66.79, 98.23, 126.23 | 66.82, 98.98, 126.63 | 66.73, 98.77, 126.63 | 66.76, 98.86, 126.61 |
| Resolution rangea (Å) | 50.0-1.06 (1.09-1.06) |
50.0-1.05 (1.08-1.05) |
50.0-1.82 (1.87-1.82) |
50.0-1.89 (1.94-1.89) |
| Completeness (%)a | 99.4 (98.7) | 99.5 (99.6) | 100.0 (99.9) | 100.0(99.9) |
| I/σ(I) a | 9.2 (2.2) | 18.1 (2.1) | 47.5 (23.4) | 48.9 (24.6) |
| Rmerge a,b | 7.2 (38.8) | 2.8 (61.5) | 2.8 (6.4) | 3.0 (6.7) |
| CC1/2 (%)a | 99.5 (78.5) | 100.0 (66.9) | 100.0 (99.7) | 100.0 (99.7) |
| Refinement | ||||
| Rwork/Rfree (%) | 11.9 / 12.7 | 12.0 / 13.3 | ||
| R.m.s.d. in bonds (Å) | 0.016 | 0.019 | ||
| R.m.s.d. in angles (°) | 1.9 | 1.9 | ||
a Values for the highest resolution shells are given in parentheses.
b Rmerge = ΣhklΣi|I(hkl)i-‹I(hkl)›|/ΣhklI(hkl).
図1. 還元型の活性部位の構造。(a)還元型(100% 窒素雰囲気下で調製した)と(b) 還元型(PDB ID:4U9H) 青色:N、赤色:O、黄色:S、白色:C、黒色:H をそれぞれ表す。Fo-Fc 差電子密度(±5.0 σ)を緑(正)および赤(負)で描画した。
酸素酸化型結晶からの回折データは、測定波長 0.9 Å では 1.05 Å 分解能、測定波長 1.48 Å では 1.82 Å 分解能、および測定波長 1.49 Å では 1.89 Å 分解能でそれぞれ収集された。構造解析を行ったところ、Rwork / Rfree (%)はそれぞれ 12.1 / 13.3 で精密化された。結晶学的統計値を表1にまとめた。
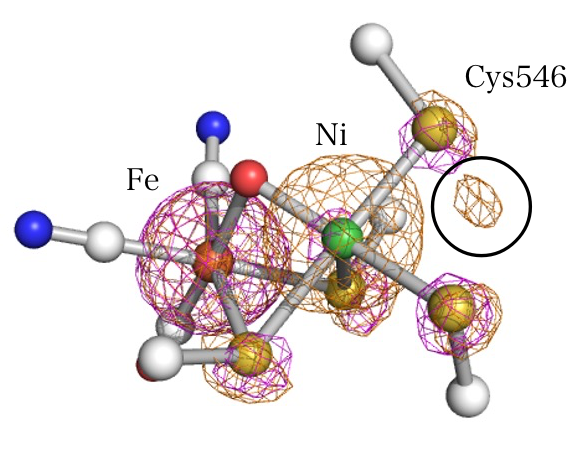
酸素酸化型の活性部位の構造と 1.48 Å および 1.49 Å での異常分散差電子密度を図2に示した。酸素酸化型の活性部位では、Fe と Ni 原子の間に酸化型に見られる µ-ヒドロキソ配位子が観測された。また、Ni の占有率は精密化の結果、およそ 0.8 と計算された。
図2. 酸素酸化型の活性部位の構造。青色:N、赤色:O、黄色:S、白色:Cをそれぞれ表す。
1.48 Å および 1.49 Å での異常分散差電子密度(5.0 σ)をオレンジおよびマゼンタのメッシュで示した。
Ni では、波長 1.48 Å のときに異常分散項の虚部が Δf”=3.8742 で最大となり、1.49 Å になると Δf”=0.4793 と小さくなる。また、この波長では Fe も異常分散効果を示し波長 1.48 Å のときに異常分散項の虚部は Δf”=3.0003、波長 1.49 Å のとき Δf”= 3.0328 である。文献[3]では、活性部位の Ni の占有率の減少について報告されているが、減少した分の Ni の行方については不明であった。図2の 1.48 Å の異常分散差電子密度(オレンジメッシュ)では、Cys546 の Sγ 原子の右下方に、ピークが観測された(黒色の〇で囲んだ位置)。一方、1.49 Å の差電子密度では、この位置にピークは観測されなかった。これらの結果から、Cys546 下方の差電子密度のピークは Ni に由来するものであると考えられた。このことから、酸素による酸化によって活性部位が構造変化し、Ni の一部が移動したことが示された。文献[3]では、実験室系のX線発生装置を使用してデータ測定が行われており、分解能およそ 1.6 – 2.0 Å で構造解析された。本研究では、放射光X線を使用したことにより、高分解能で精度の高いデータセットを測定できたため、Ni が移動する様子を検出することができた。
今後の課題:
本研究では、DvMF 由来標準型 [NiFe]ヒドロゲナーゼについて、還元型および酸素酸化型の結晶構造をおよそ 1 Å の高分解能で構造解析することにより、酸素と反応することで活性部位の Ni が移動していることを明らかにした。今後は、Ni の移動が酸素と反応したことに起因するのか、酸素は関係なく酸化されることによって引き起こされたのかを調べる予定である。また、本酵素で見られた酸化に伴う活性部位の Ni の移動は,酸素耐性型ヒドロゲナーゼでは見られていない。なぜ、本酵素でのみ Ni の移動が起こるのかも明らかにしていきたい。
参考文献:
[1] Y. Shomura et al., Nature, 479, 253 (2011).
[2] S. Eguchi et al., J. Biosci. Bioeng., 114, 479 (2012).
[3] K. Nishikawa, J. Inorg. Biochem., 177, (2017).
[4] H. Ogata et al., Nature, 520, 571 (2015).
[5] W. Kabsch, Acta Cryst. D, 66, 125 (2010).
[6] A. J. McCoy et al., J. Appl. Crystallogr., 40, 658 (2007).
[7] P. Emsley et al., Acta Cryst. D, 66, 486 (2010).
[8] G. N. Murshudov et al., Acta Cryst. D, 67, 355 (2011).
[9] M. Brecht et al., J. Am. Chem. Soc., 125, 13075 (2003).
(Received: April 1, 2020; Accepted: July 6, 2020; Published: August 21, 2020)