Volume8 No.2
SPring-8 Section A: Scientific Research Report
嫌気的アンモニア酸化細菌由来銅含有亜硝酸還元酵素の結晶化と予備的X線回折実験
Crystallization and Preliminary X-ray diffraction Analysis of the Anammox Copper Nitrite Reductase
大阪大学大学院理学研究科
Graduate School of Science, Osaka University
- Abstract
-
窒素は地球上の生命にとって必須元素であり、その自然界での循環を分子レベルで理解することは意義深い。最近の全ゲノム解析により、従来の脱窒過程だけでなく嫌気的アンモニア酸化過程においても新たな銅含有亜硝酸酸還元酵素が見つかった。本実験では、その構造遺伝子に着目し、そのタンパク質について結晶化と予備的X線回折実験を行った。
Keywords: 金属酵素、銅蛋白質
背景と研究目的:
窒素は地球上の生命にとって必須の元素であり、生物学的または無生物学的作用を介して様々な化学物質に姿を変え、自然界を循環している。その窒素循環において、水中や土壌中の窒素酸化物(NOx)は微生物の働きによる段階的な還元を経て分子状の窒素(N2)にまで変換され、大気中へと放出される(NO3- → NO2- → NO → N 2O → N2)。この過程は “脱窒” と呼ばれ、各還元段階は細菌(脱窒菌)が持つ特有の酵素群によって触媒される[1]。
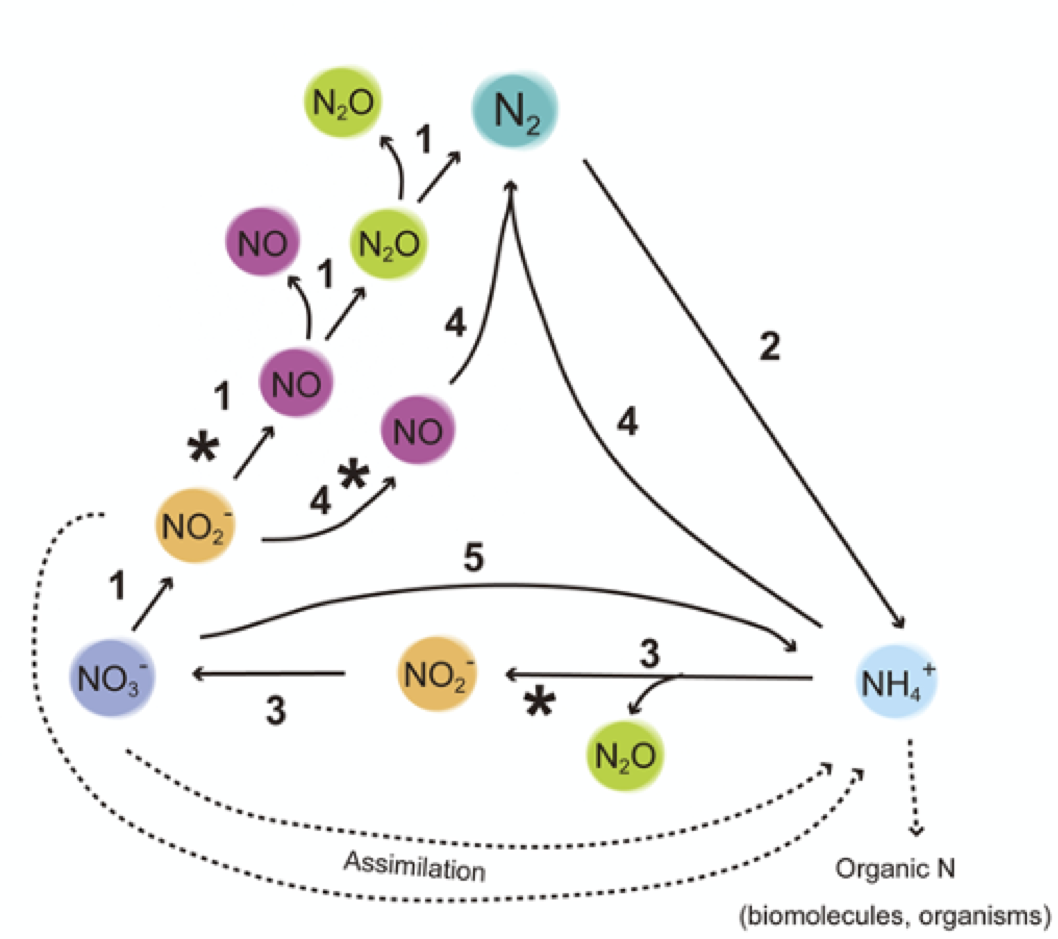
最近、上記の脱窒過程に加え、新たな窒素循環に関与する代謝経路が見つかった[2,3]。それは、NH3 を嫌気的に N2 まで酸化する嫌気的アンモニア酸化(anaerobic ammonium oxidation、Anammox)(図1)する細菌の発見である。
図1. 自然界の窒素循環概略図
1: Denitrification(脱窒)、2: Nitrogen fixation(窒素固定)、3: Nitrification(硝化)、4: Anammox (嫌気的アンモニア酸化)、 5: Dissimilatory nitrate reduction to ammonium (DNRA)(異化的亜硝酸還元)。 NO3-, nitrate; NO2-, nitrite; NO, nitric oxide; N2O, nitrous oxide; NH4+, ammonium ion。*Asterisk 星印は銅含有亜硝酸還元酵素(CuNiR)が見つかっている過程を指す。
それら Anammox に関する研究の初期に行われた反応中間体の推定実験と、Anammox 細菌 Candidatus Kuenenia stuttgartiensis の部分ゲノム解析によって、以下の3つの酸化還元反応からなる反応機構が 2008 年に提唱されている[3]。
A) NO2- + e- + 2H+ → NO + H2O (Scheme 1)
B) NO + NH3 + 3e- + 3H+ → N2H4 + H2O (Scheme 2)
C) N2H4 → N2 + 4e- + 4H+ (Scheme 3)
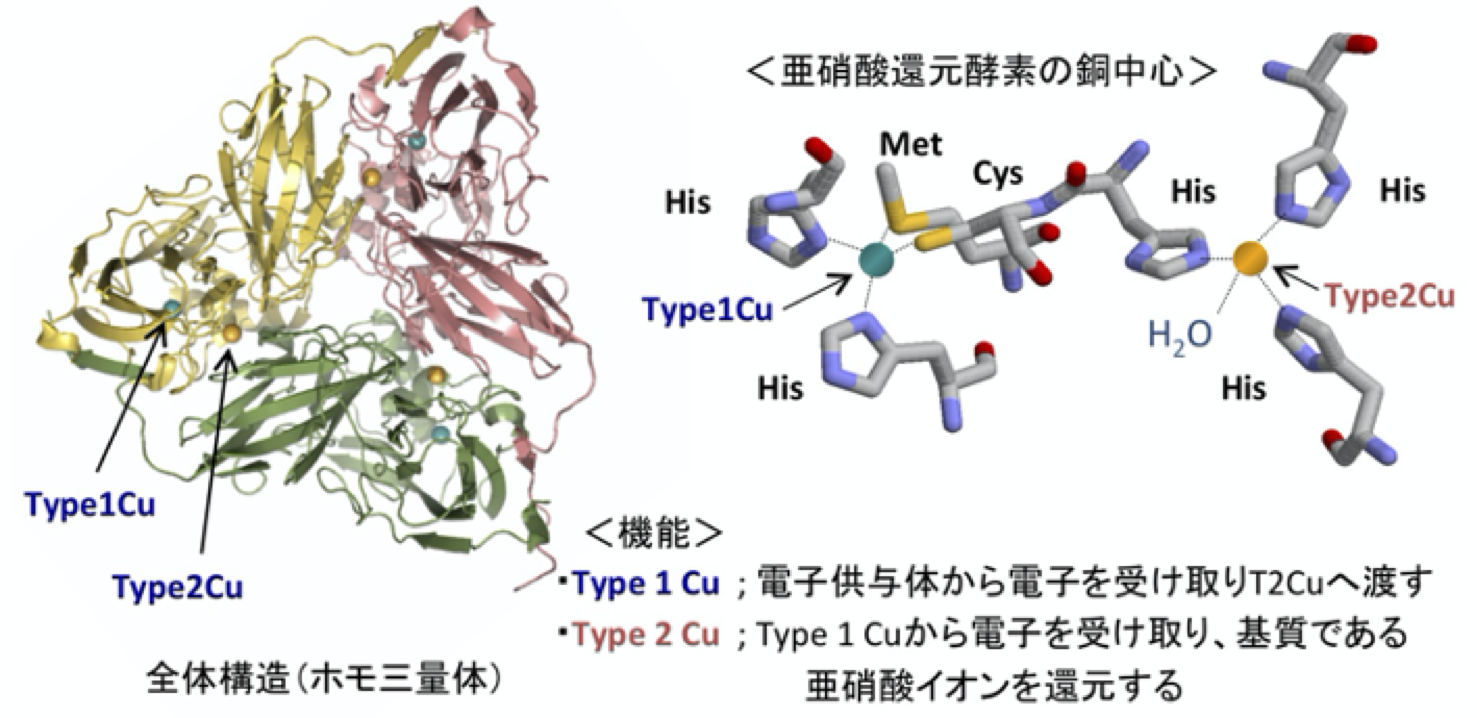
この仮説では、まず、一方の基質である NO2- が NO へと還元される(Scheme 1)。次に、生じた反応中間体 NO ともう一方の基質である NH3の間で N-N 結合が形成され、2つ目の反応中間体 N2H4 が合成される(Scheme 2)。最終的に N2H4 が N2 へと酸化される(Scheme 3)。Scheme 1 は、脱窒菌が NO3- を N2 まで還元する脱窒反応(NO3- → NO2-→ NO → N2O → N2)過程における NO2- から NO への還元反応と同一の反応である。脱窒菌には、活性中心にヘムを有する鉄型亜硝酸還元酵素をもつもの、もしくは銅を有する銅型亜硝酸還元酵素(CuNiR)(図2)をもつ菌が知られており、Ca. K. stuttgartiensis ゲノム中に鉄型酵素の遺伝子が見つかったことから Scheme 2 の過程が推定された。その後、CuNiR を有する Anammox 菌も報告され、Anammox 菌においても属種の違いによって、鉄型もしくは銅型のどちらかが機能していることがわかってきた[4]。しかしながら、その立体構造の詳細までは不明であり、本研究では Anammox 菌由来の CuNiR を組換え体として調製し、その分子レベルでの解析を行うための構造解析に必要とされる結晶化条件を見つけることを目的とした。
図2. 一般的な CuNiR の全体構造と銅結合部位。基質である亜硝酸イオン(NO2-)を1電子と2プロトンを用いて NO を生成する反応(NO2- + e- + 2H+ → NO + H2O)を触媒する。
実験と結果:
Anammox 菌 CuNiR 組換え体の調製
大腸菌での発現プラスミドは、GenScript 社の pUC57 をベースに設計され、pUC57 中に存在する LacZ の読み枠にあうように、HindIII 部位へ Anammox 菌 CuNiR 構造遺伝子(Locus Tag: KSU1_D0929)を挿入する事で作成した。その際に、N 末に 6 × His-Tag を付加し、さらに全てのコドンを大腸菌での翻訳に適したものへと変換した。
作製した発現用プラスミド pAnanirk を使って大腸菌 JM109 株をヒートショック法により形質転換し、50 µg/mL アンピシリン (Amp) を含む Luria-Bertani (LB) 寒天プレート培地で 37℃ 一晩培養し、コロニーを得た。滅菌した爪楊枝を用いてシングルコロニーを拾い、50 µg/mL Amp と 1 mM CuSO4 を含む LB 液体培地 1.5 L に植え継ぎ、30℃ 24 時間振盪培養し、本培養とした。大型冷却遠心機 himac GR 20GII (HITACHI)を用いて 4℃、6000 rpm、10 分間の遠心分離により集菌した菌体を 1 mM CuSO4 入り 40 mM Tris-HCl (pH 8.0)、10 mM imidazole、500 mM NaCl buffer に懸濁し、超音波破砕機 INSONATOR 201M(Kubota)を用いて出力 160 W で 30 分間超音波破砕を行った。超音波破砕の後、大型冷却遠心機で 4℃、15,000 rpm、60 分間遠心分離した。遠心上清を同 buffer で平衡化した Ni-affinity カラム(Qiagen)にのせ、同一 buffer で洗浄後、250 mM imidazole 入り buffer で目的タンパク質を溶出させた。この溶出液のうち、紫外可視吸収スペクトルの測定で Type1Cu に特徴的な波長 600 nm における強い吸収が見られた画分を集め、40 mM Tris-HCl (pH8.0)、 500 mM NaCl buffer で 12 時間透析を行った。その後、20 mM Glycine-KOH (pH 9.5) buffer でさらに2回透析し、20 mM Glycine-KOH (pH 9.5)、200 mM NaSO4 buffer で平衡化しておいた Phenyl-Sepharose カラムにのせた。サンプルをのせたカラムを同 buffer で洗浄後、20 mM Glycine-KOH (pH 9.5)、2%(v/v) glycerol buffer で溶出させた。
この溶出液のうち、紫外可視吸収スペクトルの測定で Type1Cu の吸収(波長 600 nm 付近)が確認できる画分を集め、これを最終精製物とし Centriprep YM-10 (Merck Millipore)を用いて濃縮後、液体窒素で急速に凍結させ -80℃ で保存した。
Anammox 菌 CuNiR(AnaNIRK)の結晶化と予備X線回折実験
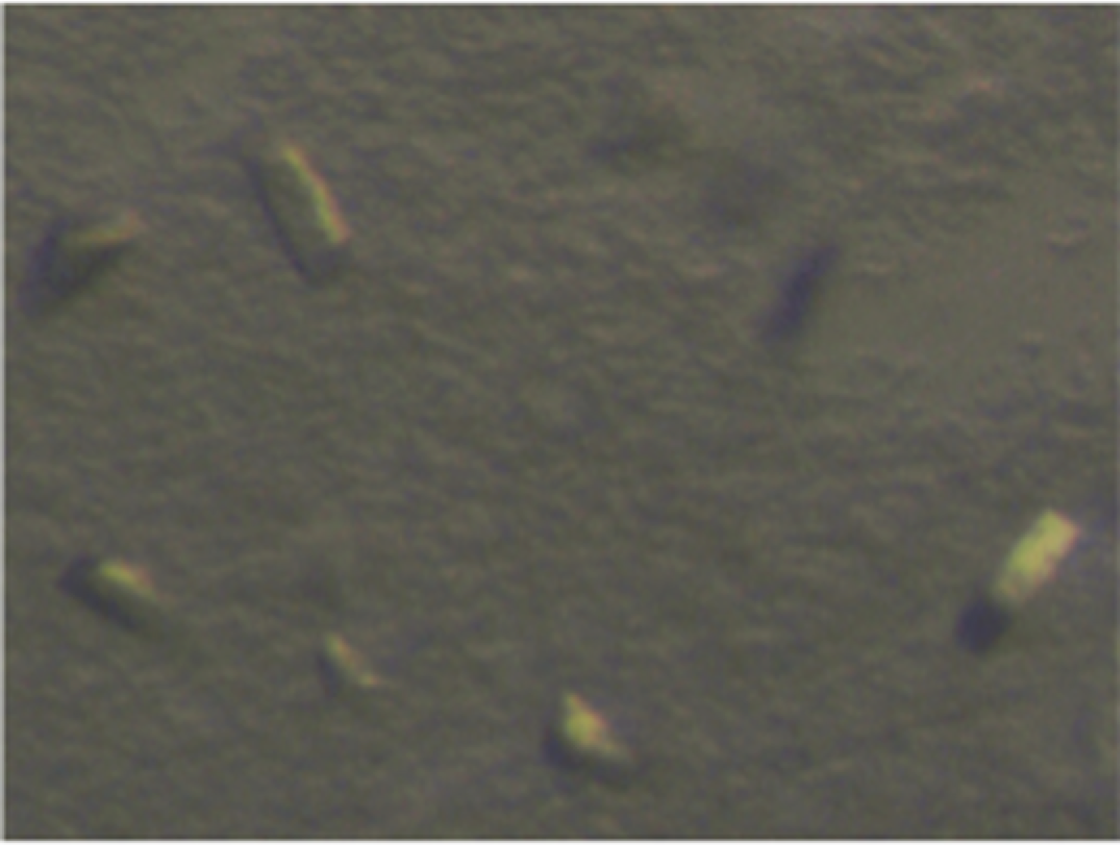
結晶化は、Hampton Research 社のスクリーニングキット(Crystal Screen I, II, PEG/ION Screen, MembFac Screen)を用い、ハンギングドロップ法にて 16℃ で行った。はじめに Crystal Screen I の No.32(2 M Ammonium sulfate)で微結晶が得られ、続いてその条件をもとにしたAdditive Screen(Hampton Research)を行い、最終的に 2.25 M Ammonium sulfate、10%(v/v) 2-propanol の条件で 0.05 x 0.05 x 0.075 mm3 程の結晶が得られた(図3)。予備X線回折実験は SPring-8 BL44XU にて測定温度 100K で行った。
図3. AnaNIRK の微結晶
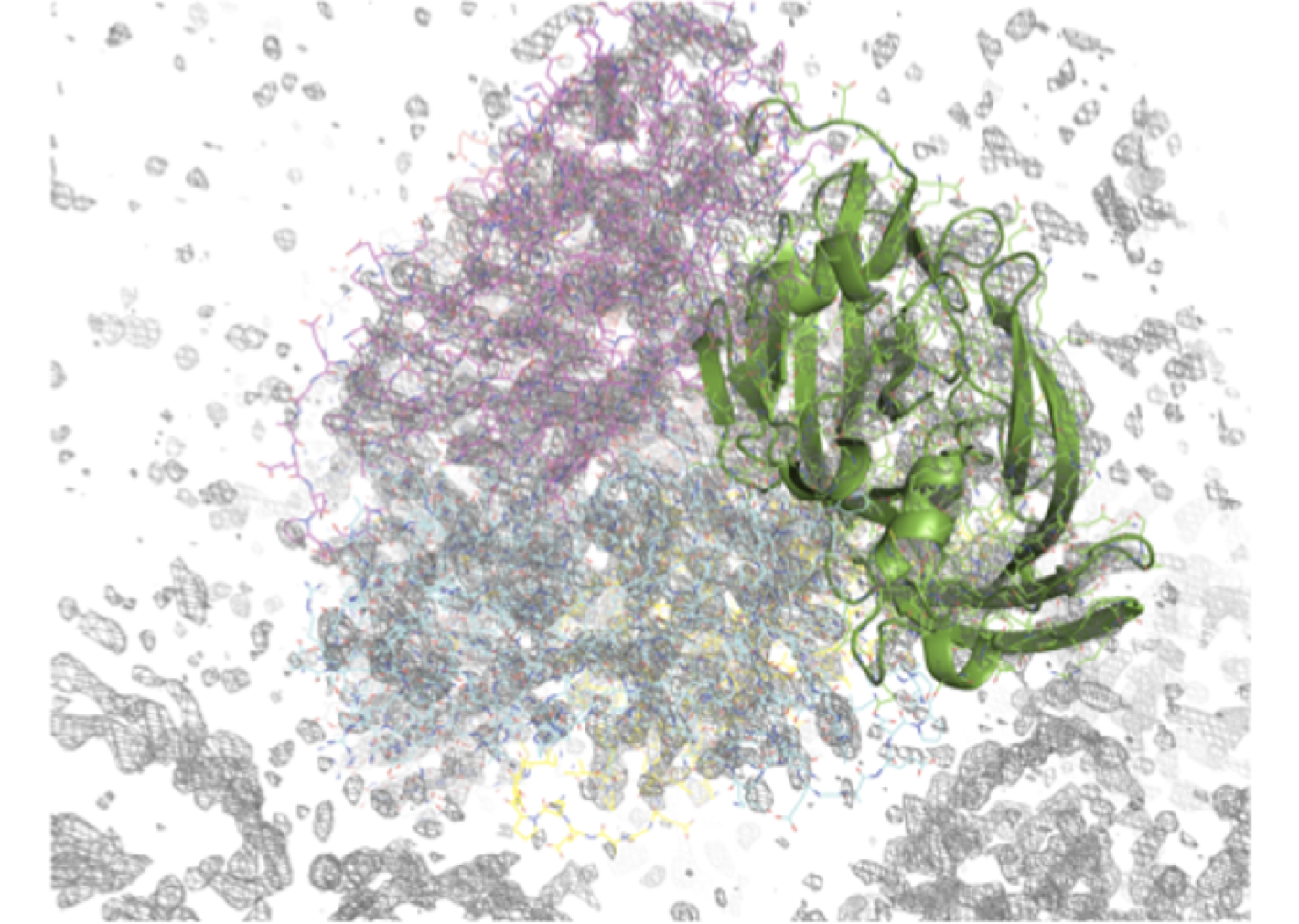
本結晶の回折は、検出器に Rayonix 社 MX-300 HE を用い、波長 0.9000 Å のX線ビーム1秒の露光(振動角1度)で、およそ 〜3.2 Å 程の分解能で得られた(図4)。空間群および格子パラメーターは、R32、a,b = 270、c = 130 Å 程であることが判明した。そのまま回転角 180 度まで連続データ測定後、測定回折データを XDS により処理し、最終的に分解能 3.4 Å で Completeness 99.7% の回折データ取得に成功した(表1)。得られた結晶の格子体積は 8.237×106 Å3 程であり、一般的なホモ三量体 CuNiR の分子量(およそ100 kDa)で Matthews coefficient (VM)を見積もったところ、三量体1分子で VM = 4.37 Å3/Da、%solvent = 71.9、2分子で VM = 2.18 Å3/Da、%solvent = 43.7 であることがわかった。続いて、この回折データをもとに初期検索モデルとして AnaNIRK と 〜30% のアミノ酸相同性を示す Neisseria gonorrhoeae CuNiR (PDB ID: 1 kbw)三量体構造座標を用いて分子置換ソフト MolRep を用いた分子置換法により初期位相の探索を行った。結果、三量体1分子を解として見つけることに成功し、Refmac5 を用いて rigid-body refinement 後、Rfactor = 〜50% 程度の値を得ることができた。そのときの 2FO - FC 差フーリエマップを図5に示す。現在、さらに構造精密化ならびに良質な結晶化条件の探索を継続している。
| AnaNIRK | |
| Space group | R32 |
| Cell parameters, Å | a, b=270.6, c=129.9 |
| Resolution, Å (outer shell) |
50.0-3.40 (3.60-3.40) |
| Unique reflections | 48.746 |
| Completeness, % (outer shell) |
99.7 (98.8) |
| Rmerge (outer shell) |
17.4 (77.5) |
| Rmeas (outer shell) |
19.5 (86.0) |
| CC(1/2) (outer shell) |
0.989 (0.775) |
| Date redundancy (outer shell) |
5.2 (5.3) |
| Average I/σ (outer shell) |
5.8 (1.2) |
図4. X線回折スナップショット(振動角1度)
図5. 分子置換後の 2FO - FC 差フーリエ電子密度マップ(1.5σ)
電子密度をグレー色メッシュで、分子置換により得られた三量体
構造を重ねて表示させている。(鎖の違いにより、水色(ワイヤー)、
ピンク(ワイヤー)、緑(リボン)で示している。
今後の課題:
今回の研究により、Anammox 菌が持つ銅含有亜硝酸還元酵素の予備的結晶化条件を見つけることができた。今後、さらなる良質な結晶化条件を見つけ、もっと高分解能のデータを得ることにより本酵素の詳細な分子機構を明らかにできると期待される。
参考文献:
[1] W. G. Zumft, Microbiol. Mol. Biol. Rev. 61, 533 (1997).
[2] A. Mulder, et. al., FEMS Microbiol. Lett., 16, 177 (1995).
[3] J. G. Kuenen, Nature Rev. Microbiol., 6, 320 (2008).
[4] D. Hira et. al., FEBE Lett., 586, 1658 (2012).
(Received: March 29, 2020; Early edition: June 26, 2020; Accepted: July 6, 2020; Published: August 21, 2020)