Volume8 No.2
SPring-8 Section A: Scientific Research Report
X線1分子計測法を用いた生きている細胞内でのG蛋白質共役型受容体1分子の動態計測
The Kinetics of a Single G-protein-coupled Receptor in a Living Cell using Diffracted X-ray Tracking
a 日本大学, b東京大学, c (公財)高輝度光科学研究センター
a Nihon University, b The University of Tokyo, c JASRI
- Abstract
-
本研究の目的は、X線1分子計測法(DXT)を用いることで生きている細胞内で GPCR (G 蛋白共役型受容体)1分子の回転・偏心運動を捉え、GPCR が3量体 G 蛋白質分子を活性化する過程を明らかにすることである。本研究は、DXT を生きている細胞に適用する世界で初めての試みである。
Keywords: GPCR、生きた細胞内計測、X線1分子追跡法
背景と研究目的:
GPCR は、ゲノムに約3000個存在するヒト最大の遺伝子ファミリーであり、ホルモンや神経伝達物質の受容体として生体の恒常性維持に決定的な役割を果たしている膜貫通受容体である。現在使用されている臨床治療薬の半数以上が GPCR ファミリーに作用するものであり、創薬ターゲットとして最も有望な分子である[1, 2]。GPCR は細胞外領域でリガンドと結合し、細胞内領域でGタンパクと相互作用することにより、リガンド刺激を細胞内に伝えている。ところが、GPCR とGタンパクの結合様式には論争がある。GPCR とGタンパクは不活化時には解離しており、GPCR がリガンドと結合して活性化されるとGタンパクがリクルートされてくるという説と、はじめから GPCR とGタンパクは結合しているという説が対立している。
GPCR とGタンパクの結合・解離は GPCR の運動性に影響を与えるはずである。仮に GPCR とGタンパクが常に複合体を形成しているのだとしても、リガンド依存的な結合様式の変化は起こるはずである。事前に行った蛍光1分子観察の結果によると、ビデオレート(1 frame / 33 msec.)で見る限り、リガンド結合の有無は GPCR の膜内での側方拡散速度に影響を与えないことがわかっている。リガンド依存的な変化が起こるとすれば、GPCR 分子の回転・偏心運動によりはっきりと影響が現れるはずである。
DXT [3]は、前記の変化が仮にいかに小さくとも、持ち前の超高時空間分解能を遺憾なく発揮して GPCR とGタンパクの結合様式の変化を敏感に捉えられる。サブミリ秒の時間分解能で、サブオングストロームの空間分解能を持つ測定技術は DXT をおいて他にない。
実験:
CHO-K1 細胞(Chinese Hamster Ovary Cell, チャイニーズハムスター卵巣由来上皮細胞株)に遺伝子導入を行い、GPCR ファミリーの一つである FPR1(Formylpeptide Receptor 1)の安定発現株を樹立した。FPR1は 走化性因子受容体の一つであり、バクテリア由来ペプチドであるフォルミルペプチドをリガンドとする GPCR である。CHO-K1 細胞に内在性 FPR1 が存在しないことは確認済みである。FPR1 安定発現株をカプトンフィルム上で培養し、カプトンフィルムの全面を細胞で覆う(図1)。これに、FPR1 のリガンドであるフォルミルペプチドをコーティングした金ナノ結晶を投与し、FPR1 とフォルミルペプチド間の受容体-リガンド特異的結合を利用して FPR1 を金ナノ結晶でラベルする。生きている細胞の細胞膜上で FPR1 を金ナノ結晶でラベルすることになる。細胞密度は 1.0 × 105 個/cm2、細胞1個あたり金ナノ結晶数十個をラベルできた。
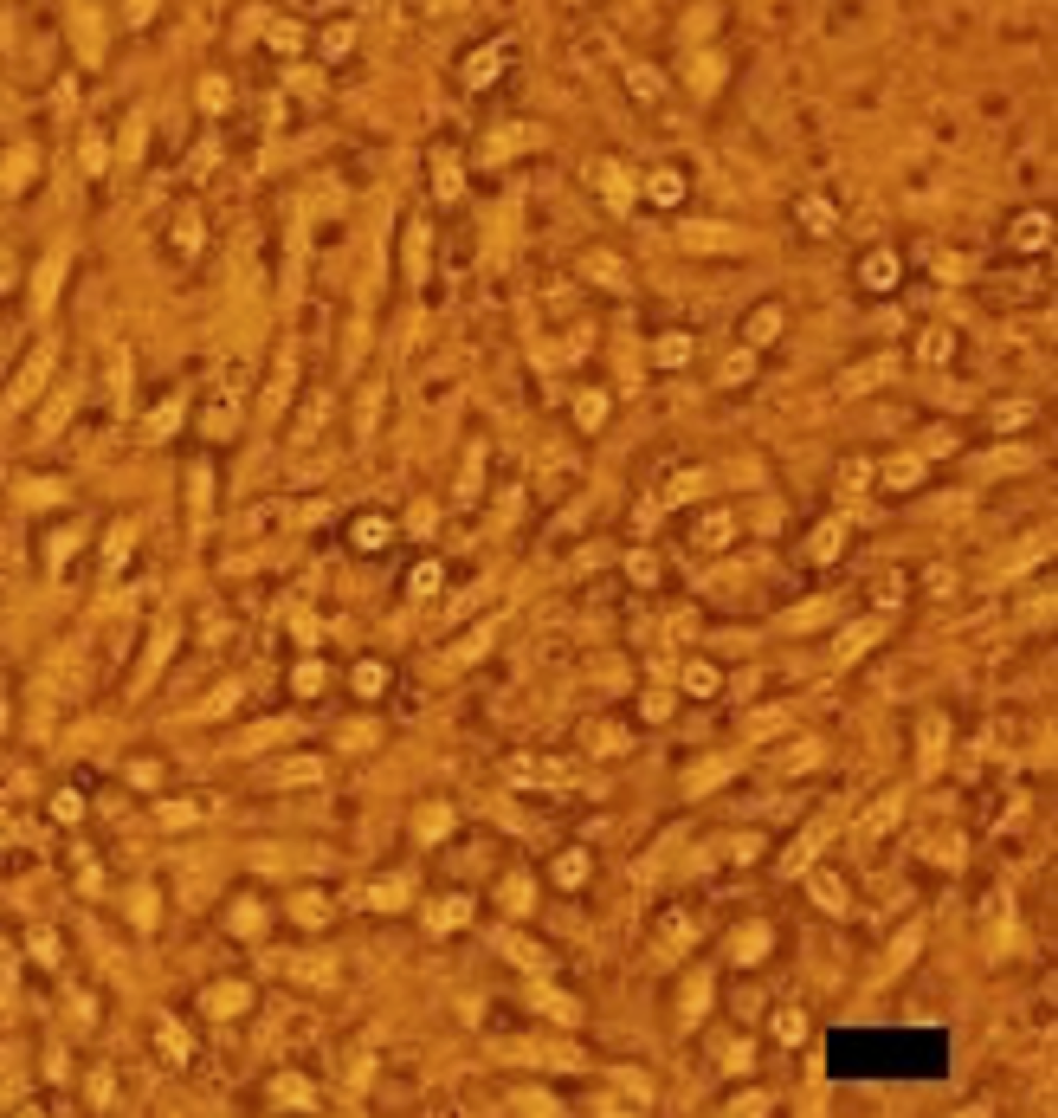
図1. カプトンフィルム上に培養した FPR1 安定発現 CHO-K1 細胞。写真は位相差顕微鏡像。スケールバーは 200 μm。カプトンフィルムは使用前に高圧蒸気滅菌している。カプトンフィルムの全面に一様に張り付いて生育している。生育速度は付着細胞用に表面処理されたディッシュにやや劣る。
金ナノ結晶を FPR1 に結合させるためと、FPR1 を活性化状態にするために、FPR1 のリガンドであるフォルミルペプチドで金ナノ結晶をコーティングする。今回使用するフォルミルペプチドはN末端がフォルミル化されている6アミノ酸残基からなるペプチドである。C末端残基が Cys になっており、この側鎖の SH 基が金ナノ結晶と結合する。注意点としては、金ナノ結晶は、リガンドを介して GPCR に結合させることになるので、リガンド刺激依存的な GPCR の細胞内取り込みが起こることが予想される。受容体の細胞内取り込みは分子運動解析の障害となる可能性があるので、Streptolysin O を使用して細胞膜の透過性を高め GPCR の細胞内取り込みを抑制する。
また、金ナノ結晶はチオールを介して細胞膜上のタンパク質に非特異的に結合してしまうという問題を持っている。これを克服するために、金ナノ結晶表面に FPR1 のリガンドであるフォルミルペプチドを結合させつつ、金ナノ結晶の表面を何らかの方法でコーティングするプロトコールを確立しなければならない。アルキル鎖の最も短いアルカンチオール化合物として β-met(β-mercaptoethanol)を金ナノ結晶保護材として利用できるのではないかと考え以下の実験を行った。1mM β-met を含む水溶液および含まない水溶液に金ナノ結晶を分散させ、それぞれ細胞に投与して細胞1個あたりに結合する金ナノ結晶を数えた。その結果、β-met を含む水溶液の場合、細胞に結合する金ナノ結晶の数が有意に低下した。さらに、β-met が存在すると金ナノ結晶同士の凝集が抑制されることが見いだされた。上記の結果から β-met が金ナノ結晶保護材として有効であると判断し、フォルミルペプチドと金ナノ結晶の反応時に β-met を共存させることにした。さらに、C 末端を Cys 残基にしたフォルミルペプチド自体に保護効果があることが見いだされた。上記の結果は生きている細胞に発現している膜貫通受容体を特異的にラベルすることが十分可能であることを示している。
FPR1 を測定対象分子に選んだ理由の一つは、FPR1 のリガンドが低分子ペプチドであることにある。DXT に使用する金ナノ結晶は非特異的に細胞膜に結合してしまう。ところが、金ナノ結晶をフォルミルペプチドでコーティングすると細胞膜への非特異的吸着が抑制される。フォルミルペプチドは FPR1 が発現していない限り直接細胞に結合することは全くない。直径が数ナノ~十数ナノメートルもあるタンパク質と比べ、フォルミルペプチドは Cys 残基を介して金ナノ結晶表面を比較的高密度で覆うことができていると考えられる。つまり、フォルミルペプチドは FPR1 のリガンドとして働く一方で、金ナノ結晶の細胞膜への非特異吸着を抑制する低分子コーティング剤としての機能を併せ持っている。雑多なタンパク質や脂質分子などの固まりとも言える細胞を、生かしたまま測定するに当たって、FPR1 を対象分子とするのは一定定の合理性がある。
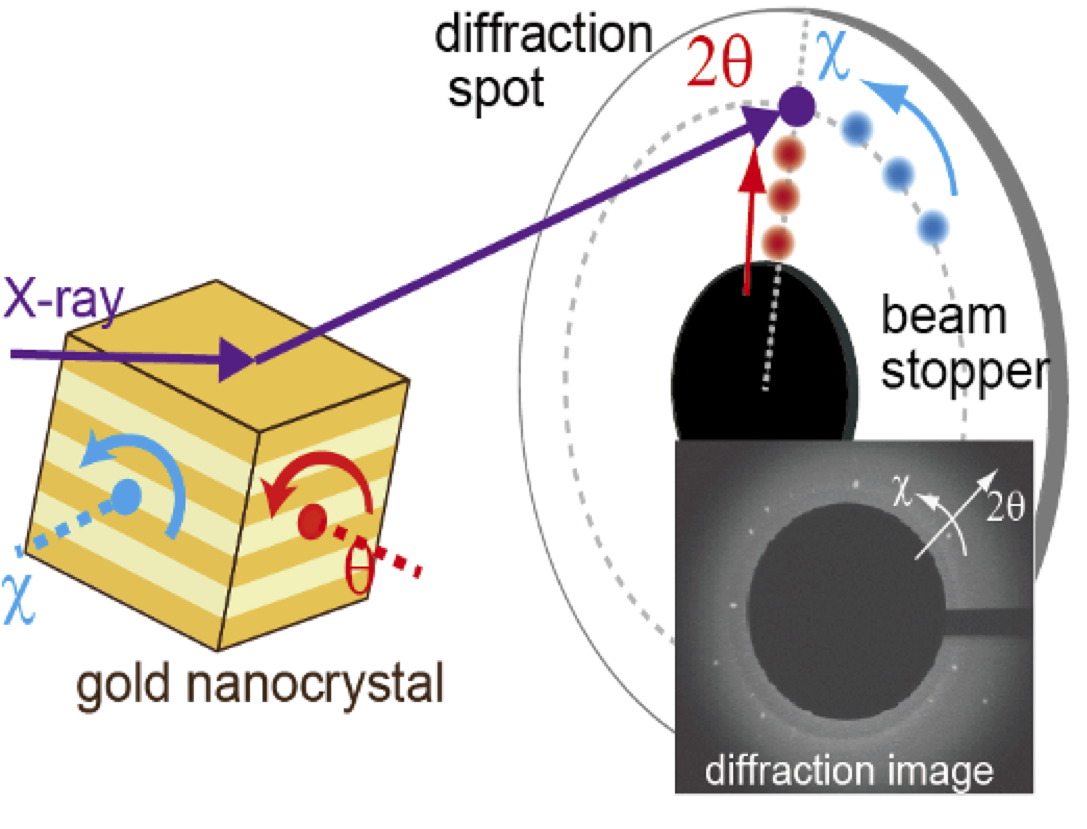
DXT 測定には BL40XU の DXT モード(入射X線エネルギー15.8 keV, ΔE/E =10% 程度、1013 photons/sec.,ビームサイズ 0.15 mm (Hor.) x 0.05 mm (Ver.))を用い、サンプル-検出器間距離 90 mm にてX線イメージインテンシファイア(V5445P, 浜松ホトニクス)-CMOS カメラ(SA 1.1, Photron, Japan)を配置させ時分解回折動画測定(0.1 msec./frame,露光時間 15 msec.)を行った(図2)。
図2.DXT 法の測定原理と回折角の定義。金ナノ結晶入射した白色X線は、X線に対する結晶の角度に応じて回折され、回折ラウエ斑点を生じる。X線の入射位置には多数の金ナノ結晶が存在するため、実際の検出イメージには多数の回折点が観察される。
結果および考察:
FPR1 発現 CHO 細胞のカプトンフィルム上での培養条件と金ナノ結晶をフォルミルペプチドラベルする最適条件を見出したので、実際に DXT 測定をすることにした。
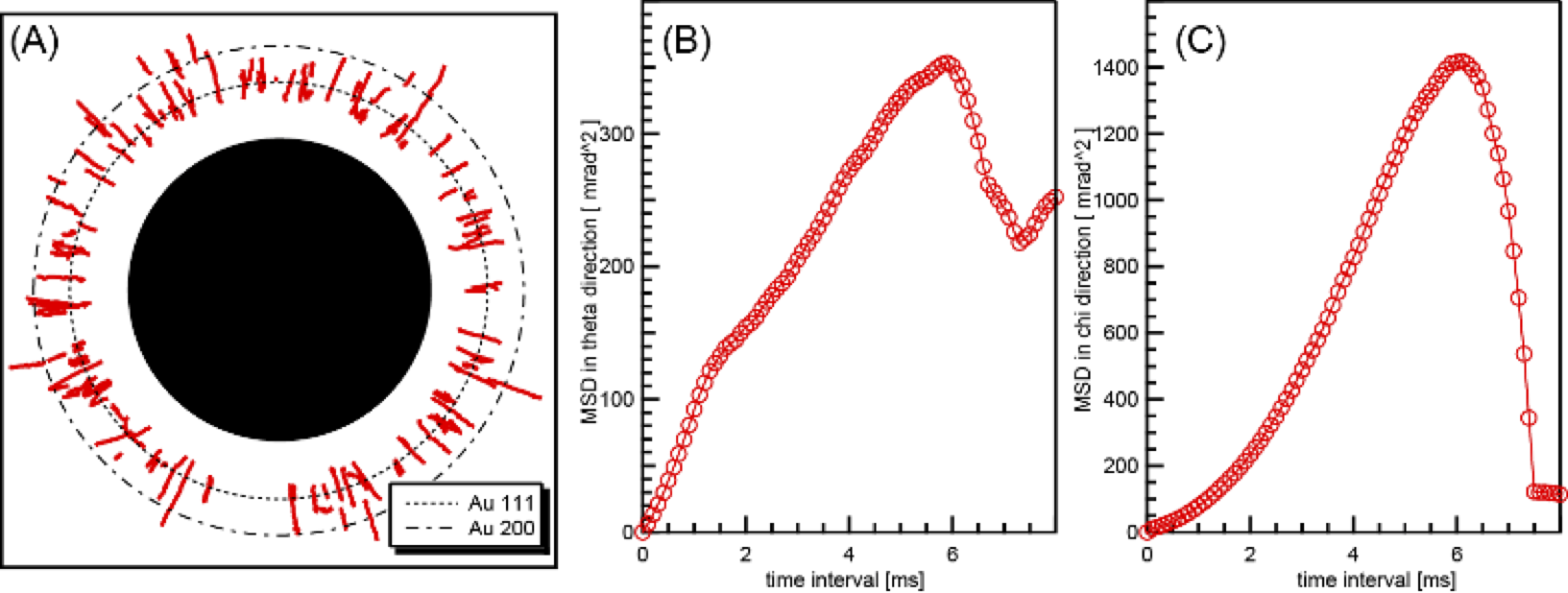
まず、Streptolysin O 処理によって FPR1 発現 CHO 細胞における受容体のリガンド依存的細胞内取り込みを抑制しておく。次に、細胞を氷上で冷やしながらフォルミルペプチドラベル化金ナノ結晶を細胞に添加した。インキュベーションを2時間行い、沈降したフォルミルペプチドラベル化金ナノ結晶によって FPR1 発現 CHO 細胞を標識した。バッファ溶液中にある残余のフォルミルペプチドラベル化金ナノ結晶は洗浄して取り除いた。こうして準備した細胞にX線を照射してDXT測定を行った。測定結果である金ナノ結晶由来の回折点の軌跡(図3A)と軌跡を解析して得られた MSD(平均二乗変位)カーブ(図3B,C)を示す。
図3 FPR1 発現 CHO 細胞に結合したフォルミルペプチドラベル化金ナノ結晶由来の回折点の挙動 A)回折点の軌跡 B)回折点の軌跡から得られた θ 方向 MSD カーブ(mrad2/msec.) C)回折点の軌跡から得られた χ 方向 MSD カーブ(mrad2/msec.) A)各回折点の軌跡は赤で示されている。金 111, 200 面由来の回折線(15 keV 相当)の予想位置はそれぞれ点線と破線で示されている。中央の黒の領域はビームストップによる影に相当する。
ネガティブコントロールとして FPR1 を発現していない CHO 細胞にフォルミルペプチドラベル化金ナノ結晶を添加したサンプルを用いた。ネガティブコントロールでは今回の測定では回折点が全く観察されなかった。これは、フォルミルペプチドラベル化金ナノ結晶が FPR1 特異的に細胞膜に結合していることを示している。
本測定では 122 個の回折点が観察された(図3A)。これらの軌跡を追跡し、100 μsec 毎の変位から MSD を算出した(図3B,C)。図3B,C によれば、照射開始からおおむね 6 msec. 程度までは安定して軌跡を追跡できると考えられる。6 msec. を超えてくると消失するなどして追跡できない回折点が出てくる。このため MSD カーブの挙動は不安定になる。
一方、DXT 測定に伴って、高輝度X線を照射することによる生きている細胞に対するダメージがあることが予想される。図4にX線照射後の FPR1 発現 CHO 細胞の位相差顕微鏡像を示す。X線照射前の細胞(図1)と比べると、細胞の輪郭がなくなり、核のみが観察される。細胞膜が溶けてなくなってしまったかのように見える。高輝度X線照射は明らかに細胞にダメージを与え、照射後の細胞はおそらく死滅していると考えられる。
図4 高輝度X線照射後のカプトンフィルム上の FPR1 安定発現 CHO 細胞。写真は位相差顕微鏡像。スケールバーは 200 μm。X線照射時間は 15 ミリ秒。細胞間および細胞の輪郭のコントラストが希薄に見える。
今後の課題:
本実験において世界で初めて GPCR のリガンド反応後の動態挙動変化を生きた細胞上で1分子計測することに成功した。同時に、エネルギー幅の広い高輝度X線(入射X線エネルギー 15.8 keV, ΔE/E =10% 程度、1013 photons/sec.,ビームサイズ 0.15 mm (Hor.) x 0.05 mm (Ver.))を照射する DXT 測定において、X線照射中に細胞膜自身に大きなダメージを与えていることが明らかとなった。
X線による細胞への損傷を抑制しつつ、DXT による膜タンパク質の動態情報シグナルを効率よく取得する改善が必要である。直ちに講じることができる解決策として一つ考えられるのは、X線照射から細胞膜破壊に至るプロセスを明らかにし、生理的に意味のある(=細胞膜が破壊される前の状態を保っている)照射時間内での測定結果を用いて解析を行うことであろう。
参考文献:
[1] K. L. Pierce et al., Nat. Rev. Mol. Cell Biol., 3 (9), 639 (2002).
[2] S. G. F. Rasmussen et al., Nature, 450 (7168), 383 (2007).
[3] H. Sekiguchi et al., Sci. Rep., 8 (1), 17090 (2018).
(Received: April 27, 2020; Early edition: June 26, 2020; Accepted: July 6, 2020; Published: August 21, 2020)