Volume8 No.2
SPring-8 Section A: Scientific Research Report
培養細胞内におけるヨウ素化ホウ素クラスター分子の局在解析
Localization Analysis of Iodine-Conjugated Boron Cluster in Culture Cells
a東京工業大学 科学技術創成研究院 化学生命科学研究所, b(公財)高輝度光科学研究センター
a Laboratory for Chemistry and Life Science, Institute of Innovative Research, Tokyo Institute of Technology, bJASRI
- Abstract
-
ホウ素中性子捕捉療法(BNCT)のためのホウ素薬剤候補分子であるホウ素化コレステロールの細胞内局在を BL37XU での蛍光X線イメージング(XRF)により明らかにすることを目的とした。Prolene film (厚さ 4 µm)上に HeLa 細胞を接着させ、ヨウ素を標識したホウ素化コレステロールを処理後、固定化することで、測定サンプルを調整した。ヨウ素の細胞内局在を XRF により観測したところ、測定中に細胞固定化フィルムの破断が生じ、ヨウ素の細胞内局在の解明には至らなかった。
Keywords:ヨウ素、ホウ素クラスター、細胞内局在
背景と研究目的:
新しい低侵襲治療法の1つであるホウ素中性子捕捉療法(BNCT)は、低エネルギーである熱・熱外中性子がホウ素との核反応により生ずる強力な粒子線を用いるものであり、がん部位へホウ素デリバリーと中性子線のダブルでの癌選択的な作用が可能であることから、“メス” を使わない QOL の高い低侵襲治療法として注目されている。
我々は高集積化ホウ素リポソームの開発に成功しており、担癌マウスに対して高い BNCT 効果を見出している。しかし、細胞内におけるホウ素リポソームやその構成成分であるホウ素化脂質分子の微小分布と中性子照射による抗腫瘍効果の関係に関しては、まだ明らかにされていない。そこで、本研究では、細胞内におけるホウ素リポソームの微小分布が、中性子照射による抗腫瘍効果に与える影響を明らかにすることを目的とした。これにより、単なる腫瘍内ホウ素濃度だけでなく、その細胞内局在を制御することにより、高い抗腫瘍効果の発現に繋げることができ、新しいホウ素薬剤の分子設計に役立つことが期待できる。
そこで、ホウ素化コレステロールのヒト子宮頸がん細胞株 HeLa 細胞における細胞内分布を BL37XU で観測することを目的とした。BL37XU におけるエネルギー範囲での µ-XRF 分析に適用可能なヨウ素原子に注目した。後述の方法により、ホウ素クラスターは容易にヨウ素原子による標識が可能なことから、ホウ素化コレステロールにヨウ素を結合させた分子をプローブとして用い、細胞内のヨウ素原子の局在を観察することとした。
実験:
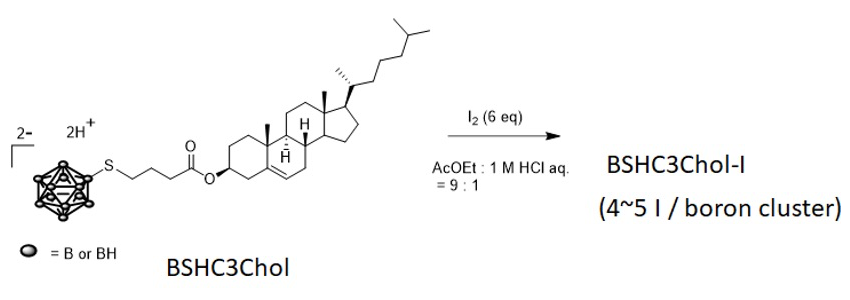
我々は、ホウ素クラスター結合型のコレステロール(ホウ素化コレステロール)の合成を報告しており、これを成分としてリポソームに組み込むことで作成されるホウ素リポソームが担癌マウスに対して高い BNCT 効果を示すことを明らかにしている[1]。Closo-Dodecaborate [B12H12]2- のアニオン構造は特異な化学的性質を有しており、ハロゲン分子(X2)と反応し、B-H 結合が B-X 結合に変換される。すなわち、ホウ素クラスターはヨウ素と反応し、共有結合を形成する[2]。そこで、以下 Scheme1 に示す反応条件によりホウ素化コレステロール(BSHC3Chol)をヨウ素化し、ヨウ素化コレステロール BSHC3Chol-I を得た(Scheme 1)。BSHC3Chol-I は質量分析により 4~5 原子のヨウ素がホウ素クラスターに結合した分子であることが示唆された。これを用いて、以下の実験に用いた。
Scheme 1. BSHC3Chol-I の合成 BSHC3Chol を6当量のヨウ素と 50℃ で40分反応させた。
測定サンプルの調製に関しては、BL37XU におけるサンプルホルダーに適用可能なサンプル形状にするために、prolene film (厚さ 4 µm)の上に HeLa 細胞が接着したサンプルを作成した。HeLa 細胞 1 x 105 cells/mL の密度で 10% FBS 含有 RPMI-1640 培地に懸濁させ、100 µL をフィルム上にのせた。その後、24時間 CO2 インキュベーターで培養することで、フィルム上に細胞を接着させた。その細胞に対して BSHC3Chol-I(33 ppm B の濃度)を1時間インキュベートし、PBS でフィルム上の細胞を2回洗浄した。その後、4% paraformaldehyde/PBS 室温15分インキュベートで固定化し、超純水で2回洗浄後、80% エタノール溶液で洗浄し、サンプルを室温で乾燥させた。得られた細胞固定化サンプルを BL37XU で蛍光X線イメージング(XRF)測定を行った。
結果および考察:
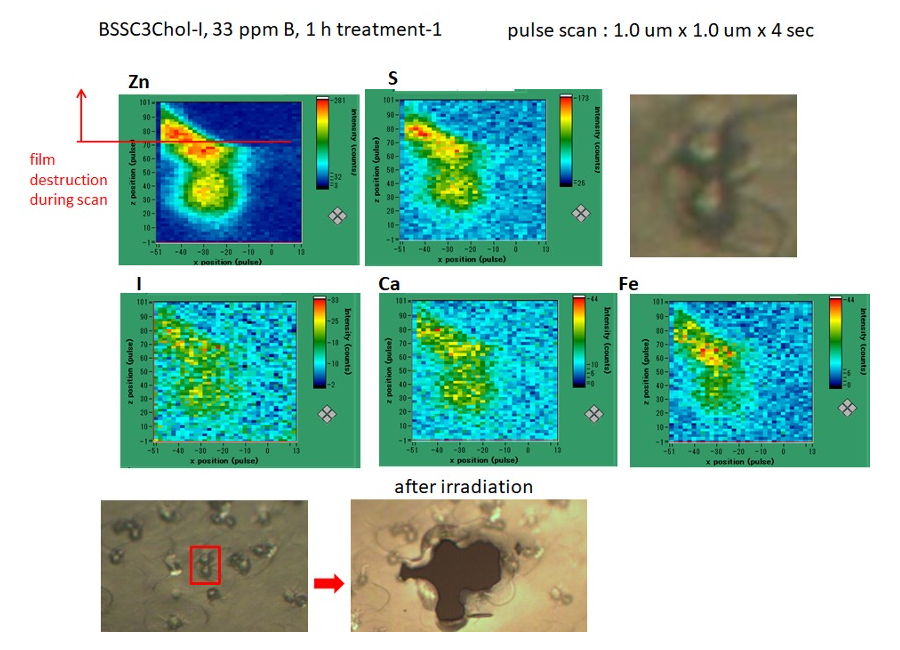
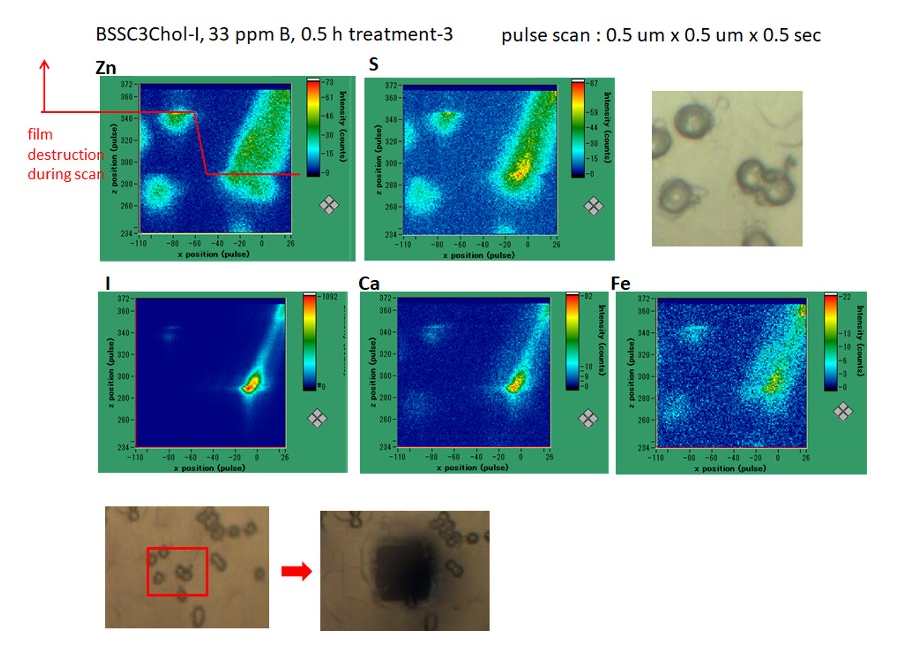
平成28年4月21日 BL37XU での実験においては、X線エネルギー=10 keV,ビームサイズ=縦 0.8 µm × 横 1.2 µm、検出器は Si SDD を用い、ヨウ素については Lα 線,その他の元素については Kα 線により検出を行った。ヨウ素のシグナルが観測された細胞に対して、pulse scan : 1.0 µm x 1.0 µm x 4 secという条件で観測を行ったところ、フィルムの破断が観測された(Figure 1)。ヨウ素が集積されていない細胞や、BSHC3Chol-I を処理していないコントロールではこの現象が観測されないことから、X線を吸収したヨウ素に由来する発熱等の現象によってフィルムが破断したものと考えられる。スキャンの条件を pulse scan : 0.5 µm x 0.5 µm x 1.0 sec や 0.5 µm x 0.5 µm x 0.5 sec(Figure 2)に変更することや、あえて取り込み量の少ない細胞を選んでの観測等を試みたが、細胞内分布を測定可能な取り込み量の細胞では全てフィルムの破断が観測されたため、結果として細胞内分布を観測するには至らなかった。ヨウ素の取り込みの低い細胞を観測した場合にはフィルムの破断は観測されなかった。
Figure 1. Pulse scan : 1.0 µm x 1.0 µm x 4 sec(1.0 µm ステップで1点辺り4秒蛍光X線を検出した。)での測定結果。測定中にィルムの破断が観測される。試料を動かしていたステージの動作量は,1パルスあたり 0.5 µm
Figure 2. 0.5 µm x 0.5 µm x 0.5 sec(0.5 µm ステップで1点辺り 0.5 秒蛍光X線を検出した。)での測定結果。試料を動かしていたステージの動作量は,1パルスあたり 0.5 µm
今後の課題:
今回 BL37XU での実験では、細胞を接着させたフィルム上でのヨウ素薬剤の観測は困難であることが分かった。対策として、ヨウ素以外のX線で観測可能な標識(例えば臭素等)や耐熱性の高いフィルム等を用いた実験等が考えられる。
参考文献:
[1] M. Ueno et al., Bioorg. Med. Chem. 18, 3059-3065 (2010).
[2] V. Tolmachev et al., Bioconj. Chem. 10, 338-345 (1999).
[3] T. Asai et al., Appl. Phys. Express 12, 112004 (2019).
(Received: September 18, 2019; Early Edition: May 27, 2020; Accepted: July 6, 2020; Published: August 21, 2020)