Volume8 No.1
SPring-8 Section A: Scientific Research Report
六量体銅含有亜硝酸還元酵素におけるブルー銅含有N末端ドメインの機能的洞察とその変異体予備X線回折実験
Preliminary X-ray Diffraction Studies for the Mutants and Functional Insights for the N-terminal Cupredoxin Domain of Hexameric Copper Nitrite Reductase
大阪大学大学院理学研究科
Graduate School of Science, Osaka University
- Abstract
-
C1 資化性脱窒菌 Hyphomicrobium denitrificans の亜硝酸還元酵素(HdNIR)は、一次構造上、一般的な銅含有亜硝酸還元酵素と相同なカルボキシ末端側ドメイン(C ドメイン、分子量 ~35 kDa)とブルー銅蛋白質に相同なアミノ末端側ドメイン(N ドメイン、~12 kDa)を併せ持ち、C ドメイン単独でも生理的電子供与体シトクロム c から電子を受け取って十分な酵素活性を示すことがわかっている。本研究では、まだ機能が未知な N ドメインとそこに存在するタイプ1銅(T1CuN)の役割を解明することを目的に、T1CuN 配位アミノ酸残基に変異を入れ銅の酸化状態を固定した試料を用い、その構造や機能について簡単な調査を行った。
Keywords: 金属酵素、銅蛋白質、マルチドメイン、酸化還元
背景と研究目的:
窒素は地球上の生命にとって必須の元素であり、生物学的または無生物学的作用を介して様々な化学物質に姿を変え、自然界を循環している。その窒素循環において、水中や土壌中の窒素酸化物(NOx)は微生物の働きによる段階的な還元を経て分子状の窒素(N2)にまで変換され、大気中へと放出される(NO3- → NO2- → NO → N2O → N2)。この過程は“脱窒”と呼ばれ、各還元段階は細菌(脱窒菌)が持つ特有の酵素群によって触媒される[1]。
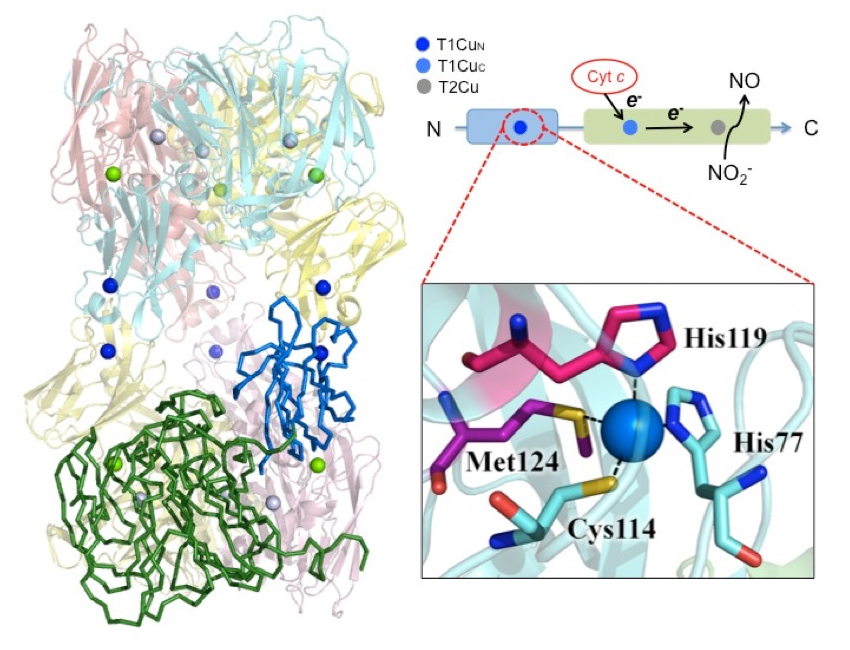
C1 資化性脱窒菌 Hyphomicrobium denitrificans 由来の銅含有亜硝酸還元酵素(HdNIR)は亜硝酸イオン(NO2-)を一酸化窒素(NO)へと一電子還元する反応を触媒する酵素であるが、その立体構造がこれまで例を見ない新規な六量体構造をしている(図1)[2]。
図1. HdNIR の六量体全体構造(左)と単量体あたりの模式図(右上)、そして T1CuN 部位の拡大図(右下)。左の六量体全体構造の中でモノマー単位の N ドメインを青色ワイヤーで、Cドメインを緑色ワイヤーで示している。図中、銅原子を玉で示している。
その立体構造で最も特徴的な点は、上下向き合った2つの三量体からの N ドメイン同士がお互い同じ面で "head-to-head" 相互作用することにより六量体構造を保持していることである。そして、これまでの生化学的解析により、本酵素の2つあるタイプ1銅のうち C ドメインのタイプ1銅(T1CuC)のみが生理的電子供与体シトクロム c からの電子受容部位として働き、タイプ2銅(T2Cu)へと電子を伝達する役割を担うことが明らかとなっている。それ故に、本酵素における T1CuN を含む N ドメインの役割が今もなお未解明なままである。
そこで、本研究では T1CuN の配位子である His119 をグリシンにして、T1CuN の酸化還元電位を大きく正側にシフトさせ常に銅一価 Cu(I) の還元状態にしたもの(H119G 変異体)、また、T1CuN の配位子である Met124 をグルタミンにして、その酸化還元電位を負側にシフトさせ常に銅二価 Cu(II) の酸化状態にしたもの(M124Q 変異体)を作成し、本酵素の構造、特に六量体構造がどのように変化するか、そしてそのときに酵素活性がどうなるか、結晶構造解析およびゲルろ過カラムクロマトグラフィーによる分子量の測定と、そしてストップトフロー法による電子伝達活性を調べることにした。
実験と結果:
1,調製変異体蛋白質の結晶化と予備X線回折実験
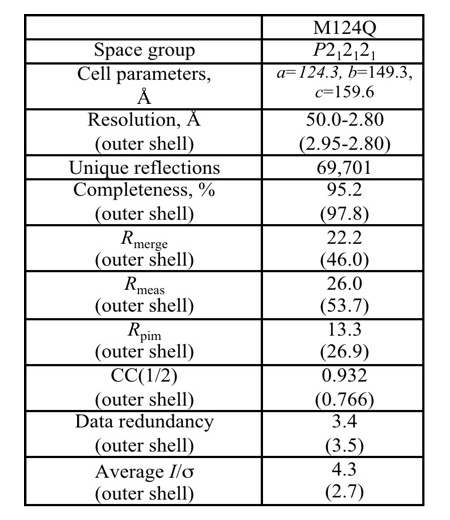
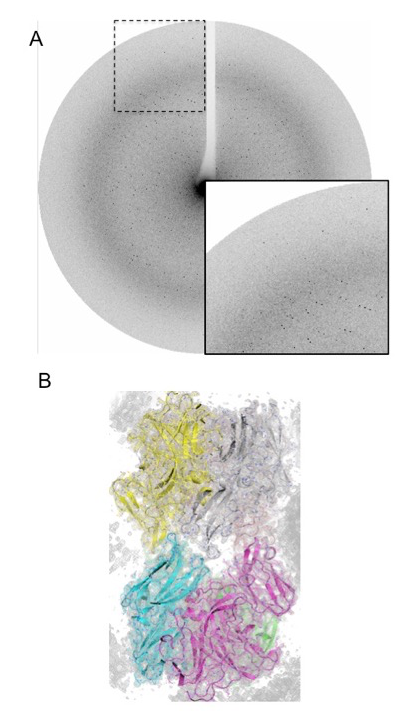
H119G および M124Q それぞれの変異体 DNA は、それぞれ該当箇所の DNA プライマーを作成し PCR 法により作成した。続いて大腸菌での発現系を用いて各変異体の発現そして精製を行った。調製タンパク質の結晶化には Hampton Research 社のクリスタルスクリーン I および II、そして PEG/ION スクリーンキットを用いた。M124Q においては 100 mM クエン酸緩衝液(pH5.6)、22.5 % PEG 400、そして 150 mM NaCl の条件で結晶が得られ、大型放射光施設 SPring-8 蛋白研ビームライン BL44XU にて回折実験を行った。結果、波長 0.9 Å のX線を用いて分解能 2.8 Å までの回折データを得ることに成功した(表1)。プログラム Molrep を使用し、野生型 HdNIR の分子構造(PDB ID:2dv6)を検索モデルとして分子置換法のテストを行ったところ、M124Q 変異体は野生型とほぼ同一の六量体を形成している可能性が示唆された(図2)。現在、さらに検討を重ねている。一方、H119G は 100 mM 酢酸緩衝液(pH4.6)、1.2 M LiSO4 の条件で棒状結晶が得られるものの、まだ分子構造が判明する程の分解能で回折データが得られていない。
表1. M124Q 変異体結晶の予備X線回折統計値
図2. M124Q 変異体結晶の予備X線回折実験のスナップショット(A)とテスト分子置換後の 2FO-FC(level, 1.0σ)電子密度(B)
2,ゲルろ過クロマトグラフィーによる分子量の推定
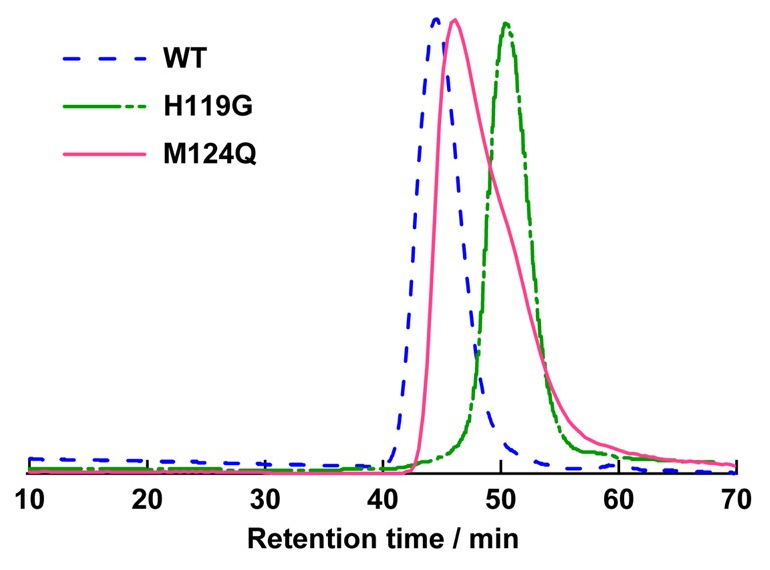
野生型(WT)、H119G 、そして M124Q 変異体のそれぞれを同一条件でゲルろ過カラム TSK-gel G3000SWXL(TOSOH)に流速 0.2 mL/min で展開させた。その結果を図3に示す。WT は 44.7 min にシングルピークを、H119G は 50.4 min にシングルピーク、そして M124Q は 46.1 および 50 min 付近に2ピーク検出された。それらのピークを分子量マーカー(MW-Marker Protein(Oriental Yeast))から算出した検量線から解析すると、それぞれ WT は ~350 kDa、H119G は ~180 kDa と見積もられ、それは六量体と三量体に相当する。また、M124Q については今回の展開条件では六量体と三量体の平衡状態にあると考えられる。これは Met124 をグルタミンに変異させたことにより N ドメイン同士の head-to-head 相互作用面の構造が僅かに変化している可能性も示唆され、これについては今後の結晶構造解析により明らかにできると期待される。
図3. 野生型(WT)、H119G、そして M124Q のゲルろ過クロマトグラフ。
3. 酸化還元パートナーシトクロムcとの電子移動反応
ストップトフロー法を用い、測定温度 25 ℃ における還元型シトクロム c から WT、H119G そして M124Q への電子移動二次速度定数を求めた。結果、(1.7±0.1) ×105 M-1s-1(WT)、(1.8±0.2)×106 M-1s-1(H119G)、そして(1.6±0.1)×105 M-1s-1(M124Q)と求まり、WT および M124Q と比べ H119G が約10倍速く電子を受け取れることが明らかとなった。
まとめと今後の課題
今回の結果を素直に捉えると、HdNIR は N ドメインの T1CuN が II 価の酸化状態のときに六量体をとり、I 価の還元状態になると六量体から三量体へと四次構造が変化すると考えられる。また、興味深いことは、安定な三量体状態をとる H119G において、シトクロム c との電子移動反応速度定数が WT や M124Q と比べ10倍以上増強されることである。これは、N ドメインの T1CuN はシトクロム c からの電子の授受には直接は関係ないが、N ドメインの T1CuN が還元されることが引き金となり六量体のときにとっていた N ドメインの配置が少し動くことで、C ドメインの T1CuC が六量体のときよりもさらにシトクロム c からの電子を受け取りやすくなる、といった本酵素にユニークな "N ドメインの酸化還元依存的な酵素活性制御機構" の存在を強く示唆させる。
参考文献:
[1] W. G. Zumft, Microbiol. Mol. Biol. Rev. 61, 533 (1997).
[2] M. Nojiri, et. al., Proc. Natl. Acad. Sci. USA., 104, 4315 (2007).
(Received: September 30, 2019; Early edition: December 9, 2019; Accepted: December 16, 2019; Published: January 22, 2020)