Volume8 No.1
SPring-8 Section A: Scientific Research Report
骨格筋収縮時のミオシン分子頭部とアクチンフィラメント間の硬直結合の構造に関する研究
Studies on the Structure of Linkages between Myosin Head and Actin Filament during Contraction in Skeletal Muscle
a帝京大学,b東京慈恵会医科大学, c(公財)高輝度光科学研究センター
aTeikyo University, bThe Jikei University, cJASRI/SPring-8
- Abstract
-
ウサギ骨格筋から作成した skinned fiber の high-Ca rigor 状態での ramp-shaped release に対する力学的反応時の構造変化を X-ray diffraction の技法によって調べたところ、EDTA(10mM)の有無に関わらず、(1)赤道反射強度比[I(1,1)/I(1,0)]と 1,0 反射の間隔(spacing)は release 後では有意に増大した。(2)actin 由来 5.9 nm 層線は赤道線方向の lateral spacing が 0.05/nm より内側では強度変化は殆ど見られないのに対して 0.05/nm より外側では強度が低下した。Actin 由来層線の強度分布は、子午線から遠ざかるにつれて、アクチンフィラメントのらせん軸により近い部分の構造を反映する。したがって、ramp-shaped release により変化するのは、アクチンに結合するミオシン頭部のアクチン結合部位付近の微細構造と考えられた。
Keywords:骨格筋、high-Ca 硬直状態、low-Ca 硬直状態
背景と研究目的:
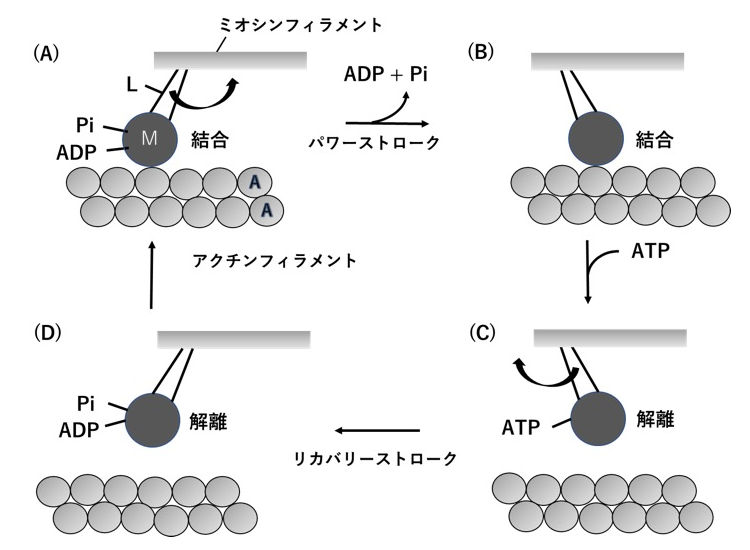
筋収縮はミオシンフィラメントから突き出たミオシン頭部(M)と、アクチンフィラメント上のミオシン結合部位(A)との間の、ATP 加水分解と共役した結合₋解離サイクルによって起こる。図1はこの考えを図解した模式図である。筋肉弛緩時に M は ATP(アデノシン3リン酸)を ADP(アデノシン2リン酸)と Pi(無機リン酸)に分解しているが、分解産物 ADP と Pi と結合した M・ADP・Pi の状態にあり、アクチンフィラメントとは解離している(図D).収縮時には、この M・ADP・Pi はまずアクチンフィラメントと結合し(図A)→(図B)の反応により Pi と ADP を放出し、筋フィラメント間の滑りを起こすパワーストロークを行うと考えられている。この化学反応は M・ADP・Pi +A → AM・ADP・Pi → AM+ADP+Pi と表される。
図1.筋収縮時のアクチンフィラメント(A)とミオシン頭部(M)の間の、ATP分解と共役した反応サイクルを説明する模式図
この考えによれば、個々の myosin head は(図A)→(図B)の反応によるパワーストローク終了後、アクチンフィラメントと結合した AM 状態をとると考えられる[1]。この AM 状態は筋肉から ATP を除去した際におこる硬直 rigor 状態に対応すると一般に考えられているが、収縮時の筋肉のX線回折像の研究からこの考えには種々の疑問が提出されている[2][3]。近年我々は、ウサギ骨格筋 single skinned fiber における high-Ca rigor(Ca 存在下で収縮させ、そのまま ATP を取り除いて作成した rigor)と low-Ca rigor(Ca 非存在下で ATP を取り除いて作成した rigor)状態での ramp-shaped release(振幅:筋長の 0.5%、 持続時間 5 ms)に対する力学反応の比較を行った。high-Ca rigor fiber では、ramp-shaped release を繰り返し与えた場合に顕著な tension recovery が長期間に亘って生じるが、low-Ca rigor fiber では ramp-shaped release 後の tension recovery が顕著でなく短時間で消失すること、また実験液中の残存 ATP の myosin head への結合を阻害する EDTA(10mM)により、high-Ca rigor fiber の tension recovery は変化しないが、low-Ca rigor fiber の tension recovery は完全に消失することを発見した[4]。
以上の実験結果から我々は、high-Ca rigor fiber と low-Ca rigor fiber における myosin head の状態は異なっており、high-Ca rigor fiber 中の myosin head の大部分は静的な AM myosin head ではなく、tension recovery を生ずるような動的な性質を持つ AM・ADP myosin head であると考えている。つまり、収縮中の skinned fiber では、パワーストローク完了時の myosin head は、従来の定説のような AM ではなく、AM・ADP であろうと考えられる。
本研究の目的は、パワーストローク終了時の dynamic な AM・ADP myosin head を多く含む high-Ca rigor fiber のX線回折像からみた ramp-shaped release 前後の構造変化の比較により、AM・ADP myosin head の構造に関する知見を得ることである。この研究により、現在停滞気味の筋収縮機構の研究が飛躍的に進展することを期待して実験を行った。
実験:
1) 骨格筋 skinned fiber の調製
ウサギ腸腰筋から取り出した筋線維束を triton-X で処理して形質膜を除去し、skinned fiberを 作製し glycerol を含む弛緩溶液(KCl 123mM; MgCl2 5.4mM, ATP 4.3mM, EGTA 10mM, PIPE 10mM、pH 7.4, pCa>9)に保存した。
2)実験液
以下の実験液を使用した。
収縮溶液: KCl 102mM, CaCl2 10.2mM, MgCl2 5.0mM, ATP 4.4mM, EGTA 10mM, PIPES 10mM, pCa, 4。
High-Ca rigor 溶液: 収縮溶液から ATP を除去したもの、pCa,4。溶液の pH はすべて PIPES により7.0とした。
3)High-Ca rigor fiber からのX線回折像の記録
skinned fiber の一端を張力記録器、他端をサーボモーターに接続し、実験槽中に水平に筋節長 2.4 µm (Lo)でマウントした。収縮液(pCa, 4)により最大収縮張力を発生させたのち、high-Ca rigor 液中で ATP を除去して high-Ca rigor 状態とし、以下の条件下でX線回折像(赤道線反射及び子午線反射)を BL45XU においてイメージングプレートを用いて記録した。X線波長は 0.9 Å であった。なお、実験液中の残存 ATP を除去するため、high-Ca rigor 液には hexokinase と D-glucose および AP5A を加えた。実験は 15°C でおこなった。
結果:
1) High-Ca rigor fiber の赤道反射に及ぼす ramp-shaped release の影響
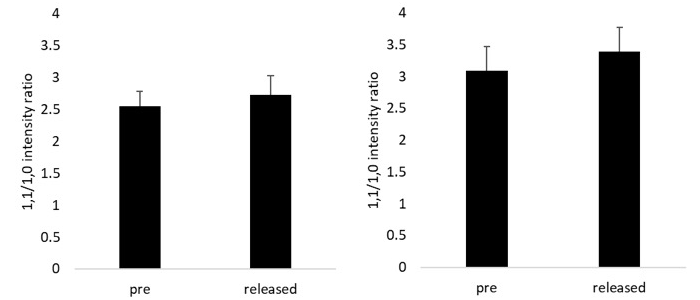
High-Ca rigor fiber の赤道反射強度比[I(1,1)/I(1,0)]は、ramp-shaped release 前には 2.54±0.23 (n=3)であるが、release 後には 2.72±0.3(平均値±標準誤差)(n=3)に増大した(t-test, p=0.17)(図2左上)。EDTA(10mM)存在下でも[I(1,1)/I(1,0)]の値は、release 前は 3.09±0.38, release 後は 3.39±0.37 で、やはり ramp-shaped release により増大した(n=5, p<0.05)(図2右上)。
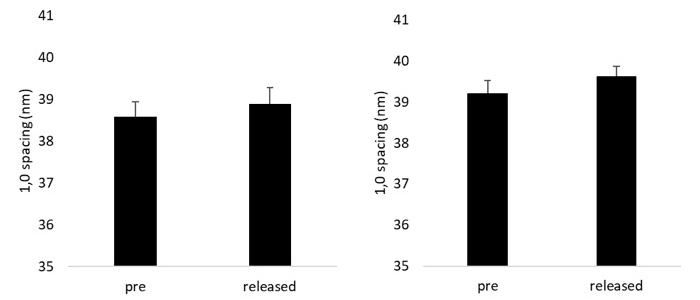
一方、high-Ca rigor fiber の 1,0 反射の間隔(spacing)は release 前、EDTA 非存在下で 38.6±0.35 nm (n=3)、 EDTA 存在下で 39.2±0.30 nm (n=5)であり、release 後ではそれぞれ 38.9±0.38 nm (n=3)、 39.6±0.24 nm (n=5)で、いずれの場合にも有意に増大した(p<0.02)(図2下)。
図2.High-Ca rigor 状態の skinned fiber の ramp-shaped release 前(pre)及び後(released)における 1,0 及び 1,1 赤道反射の強度比(上)と、1,0 反射の間隔(spacing)(下)。エラーバーは標準誤差。左は EDTA 非存在下、右は EDTA(10mM)存在下。
2) High-Ca rigor fiber の5.9 nm 層線の強度分布に及ぼす ramp-shaped release の影響
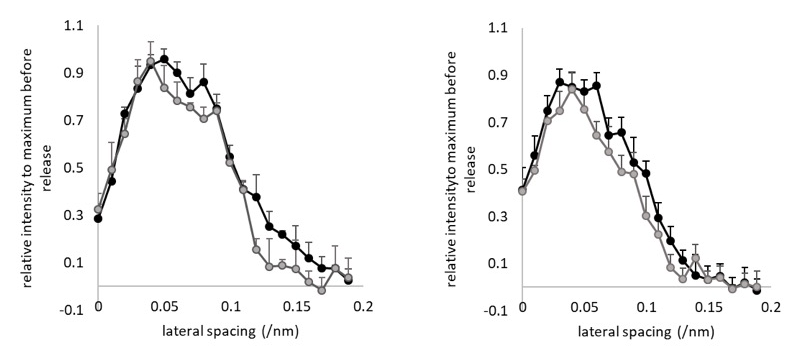
図3に示すように、Lo の 0.5% の ramp-shaped release は、EDTA の有無に関わらず、actin 由来 5.9 nm 層線に対して lateral spacing<0.05/nm では殆ど強度変化を起こさないのに対して、lateral spacing>0.05/nm では強度を低下させる傾向が見られた。Actin 由来層線の lateral spacing は、その値が大きいほど、アクチンフィラメントらせん軸に近い部分の構造を反映する。したがって、ramp-shaped release により変化するのは、アクチンに結合したミオシン頭部のアクチン結合部位付近の微細構造と考えられる。
図3.High-Ca rigor 状態の skinned fiber の、ramp-shaped release 前(filled circles)及び後(open circles)の actin filament 由来 5.9 nm 層線の強度分布の比較。
左、EDTA 非存在下の記録。右、EDTA(10mM)存在下の記録。各々の data point の縦線は±標準誤差(左の記録、n=3; 右側の記録、n=5)を表す。
考察:
本実験で用いた ramp-shaped release(振幅、0.5% Lo; 持続時間、5 ms)では、張力は0まで低下することはなく、actin-myosin head 間の rigor linkage はその角度を変えるのみで解離していないと考えられる。この考えに基づいて本実験結果の解釈をおこなう。
まず、ramp-shaped release 前の high-Ca rigor fiber 中の myosin head の多くはパワーストロークを打ち終わった状態で actin filament 上の actin monomer と rigor linkage を形成していると考えられる。この high-Ca rigor fiber 中で、myosin head 先端の catalytic domain(CAD)は actin filament 長軸にたいしてわずかに斜めの角度をとっていると仮定すると、この CAD は ramp-shaped release により、actin filament にたいする結合角度を、斜めから直角に変化させるであろう[4]。release により引き起こされるサルコメア長の短縮は赤道反射強度比[I(1,1)/I(1,0)]を増大することは古くより報告されており[5]、定性的には図1に示す本実験結果での強度比の増大を説明し得る。また、短縮に伴う 1,0 反射の spacing の増大も合理的と考えられる。しかし定量的には、文献[5]の結果から見積もると 0.5% の短縮により予想される強度比の増大量は 3% 程度となり、本実験結果で見られた増大量(7~10%)を完全には説明できない。したがって本実験で見られた赤道反射強度の変化や spacing の増大には、上述した myosin head と actin filament との結合角度の変化が関係している可能性が考えられる。Actin 由来 5.9 nm 層線の強度変化も、結合角度の変化に伴う myosin、actin 結合部の構造変化を反映している可能性がある。High-Ca rigor fiber に対して EDTA の効果が顕著ではないことは、fiber 中に形成されているのが AM・ADP myosin head であり、残存している ATP の結合の影響を受けないと考えれば説明できる。
今後の課題:
本研究では、実験手法が ramp-shaped release を含む複雑、高度なものであるため、与えられた時間内に、high-Ca rigor fiber の結果と対比すべき、low-Ca rigor fiber のX線回折像を得ることができなかった。次回の実験で low-Ca rigor fiber に関する結果を得ることが、本研究の進展に必要である。
参考文献:
[1] R. W. Lymn , E. W. Taylor, Biochemistry, 10, 4617-4627 (1971).
[2] A. Radcaj et al., Biophys. J., 96, 1430-1446 (2009).
[3] J. M. Squire, The Structural Basis of Muscular Contraction. Plenum, New York. pp 534-642 (1981).
[4] H. Sugi et al., PLoS ONE, 11, e0162003 (2016).
[5] H. E. Huxley, J. Mol. Biol., 37, 507-520 (1968).
(Received: August 16, 2019; Early edition: November 28, 2019; Accepted: December 16, 2019; Published: January 22, 2020)