Volume8 No.1
SPring-8 Section A: Scientific Research Report
Angucycline抗菌化合物のヒスチジンキナーゼ結合部位の探索
Exploring the Binding Site for Angucycline Antibiotics on Histidine Kinases
a大阪大学産業科学研究所, b近畿大学, c岡山大学, d株式会社微生物化学研究所
aISIR, Osaka University, bKindai University, cOkayama University, dInstitute of Microbial Chemistry
- Abstract
-
Angucycline 抗菌化合物 aquayamycin の結合部位を決定するため、大腸菌センサーヒスチジンキナーゼ EnvZ DHp ドメインの結晶を調製し、同化合物でソーキングした。Aquayamycin の結合によって茶褐色に変色した結晶について、X線結晶構造解析を行った。しかしながら、電子密度マップ上で、aquayamycin に対応する電子密度は認められなかった。また、Angucycline 抗菌化合物 waldiomycin に対して親和性が低下する S242A 変異型 EnvZ の DHp ドメインに関しても、X線結晶構造解析により構造決定した。
Keywords: ヒスチジンキナーゼ、X線結晶構造解析、新規抗菌薬
背景と研究目的:
センサーヒスチジンキナーゼ(HK)は細菌の主要な膜貫通型情報伝達センサー分子である。HK のセンサー領域は細胞膜表面に露出しており、外界の環境変化などの様々な情報を感知し、膜を越えて細胞内のヒスチジンキナーゼドメインに伝える。それによって、自己リン酸化活性を誘起し、最終的にレスポンスレギュレータ(RR)と呼ばれる転写調節因子が、リン酸化状態に依存して各種の遺伝子発現を制御している[1]。このようなシグナル伝達システムは、二成分情報伝達系(TCS)と呼ばれ、細菌の主要な情報伝達系である[1]。TCS は各種の病原細菌が病原性を発現することに関与しており、黄色ブドウ球菌 WalK(HK)/WalR(RR) など生育・増殖に必須なものも存在する[2]。その一方で、ヒトには TCS は存在しないことから、TCS を阻害する薬剤は新しい細菌感染症治療薬にも応用できる可能性がある[3]。したがって、薬剤開発の面から、TCS のメカニズムや低分子化合物との複合体構造を解明することの意義は、極めて高いものと考えられる。
これまでに我々の研究グループでは、Angucycline 型抗菌化合物のひとつ waldiomycin についてその解析を進めてきた。Streptomyces sp. MK844-mF10 株から単離された waldiomycin(図1)は、黄色ブドウ球菌や枯草菌などのグラム陽性細菌に対して抗菌活性を示す[4]。Methicillin-Resistant Staphylococcus aureus (MRSA)等の薬剤耐性菌にも抗菌性を示すことから新しい新規な抗菌薬のシードとして注目されている。生化学的、分子生物学的な解析の結果、黄色ブドウ球菌や枯草菌などでは、主に、生存に必須な保存性HKである WalK の自己リン酸化を阻害することによって、その抗菌作用が生じていることが判明している[4]。また、興味深いことに、waldiomycin は、大腸菌 EnvZ などをはじめ WalK 以外の広範な HK の自己リン酸化を阻害することが判明した[5]。Waldiomycin の作用部位、すなわち結合部位は各種の HK に共通した保存性の高い領域にあることが予測された。Waldiomycin と HK との共結晶構造は得られていないが、核磁気共鳴測定により EnvZ との相互作用解析を行った結果、最終的に DHp ドメインの H-box 領域近傍に結合することが判明した[5]。実際、予測された結合部位近傍に変異導入すると、EnvZ 自己リン酸化阻害に関するIC50値が増加し、waldiomycinの親和性が著しく低下することがわかった[5]。H-boxは自己リン酸化されるHis残基を含む保存性の高い領域であり、この結果は H-box 領域近傍に共通な結合部位が存在する可能性を強く支持した。Waldiomycin 誘導体の解析、変異導入実験の結果も合わせ、angucycline環がH-box近傍に結合するモデルを構築することができた。本研究は、大腸菌EnvZを用いて、angucycline 型抗菌化合物の結合部位を結晶構造解析によって決定することを目的とした。特に、waldomycin のangucycline 環と tetrahydropyran の部分構造に類似する aquayamycin に着目した。Aquayamycin の EnvZ に対するIC50(14.2 µM)は waldiomycin の IC50 (23.9 µM)よりもむしろ低く、親和性に優れていた[5]。さらに、waldiomycin は水溶性が低く、結晶ソーキングにおいて、濃度を上げることが困難であったが、aquayamycin(図1)は、水溶性が改善されており、より高濃度での結晶ソーキングが可能であった。また、waldiomycin に対して親和性が低下する S242A 変異型 EnvZ の DHp ドメインに関しても、その親和性低下の原因を明確にするため構造解析を行った。
図1. Waldiomycin(左)と Aquayamycin(右)の化学構造
実験:
大腸菌 EnvZ DHp 領域(Env-DHp; アミノ酸残基 223-289)の調製は、江口らの方法[5]に従った。まず、EnvZ-DHp は、N末端に His6 タグと TEV プロテアーゼ切断配列を付加して大腸菌発現系を用いて発現させた。菌体を超音波破砕し、Ni-sepharose カラムを用いて精製したのち、さらに、TEV プロテアーゼで His6 タグで切断した。その後、ゲル濾過によってタグと TEV プロテアーゼを除去し精製した。そのため、N末端に TEV プロテアーゼ切断配列に由来する Gly-Ala の配列が最終的に残存している。結晶化に際して、得られたタンパク質は、脱塩カラムによって 10 mM Tris-HCl (pH 8.0) にバッファー交換したのち、遠心式限外ろ過器(アミコンウルトラ、分画分子量 3000)によって約 20 mg/ml まで濃縮した。結晶化は、1.6 M Na/K phosphate (pH 6.9) と 10 mg/ml EnvZ-DHp (10 mM Tris-HCl (pH 8.0)) を 1:1 で混合し、Sitting drop 法(20 ℃)によって行った。その結果、六角錐状の結晶が約1週間で生成した。これを 30% (w/v) グルコース、10% (w/v) Dimethyl sulfoxide、および 10 mM aquayamycin を含む上記の結晶化バッファーにソーキングした。20 ℃ において20時間あるいは44時間、放置したのち、クライオループで結晶をピックアップし液体窒素で凍結した。得られた結晶は、SPring-8 BL44XU に運搬し、100K のクライオ気流下においてX線回折データを収集した。イメージデータの処理には、HKL2000 および Scalepack を用いた。位相決定は、リガンドフリーの EnvZ-DHp の結晶構造(PDB ID: 5B1N)をモデルとして Phaser による分子置換法によって行った。構造精密化計算には Refmac 5 および Phenix、モデル修正は Coot を用いた。X線回折データの処理および構造精密化計算の統計値は表1に示した。
S242A 変異 型EnvZ-DHp に関しても、同様に結晶化し、30% グルコースをクライオプロテクタントとしてX線結晶構造解析を行った。
| Soaked with aquayamycin | S242A | |
| Data collection | ||
| wavelength (Å) | 0.90 | 0.90 |
| space group | P62 | P62 |
| unit cell dimension | ||
| a, b, c (Å) | 38.545, 38.545, 84.591 | 38.166, 38.166, 84.270 |
| no. of observations | 150583 | 187996 |
| no. of unique reflections | 13413 | 37039 |
| resolution range (Å) | 33.38 - 1.42 (1.44 - 1.42) |
33.05 - 1.40 (1.43 - 1.40) |
| multiplicity | 11.2 (10.4) | 7.0 (5.6) |
| completeness (%) | 99.0 (84.3) | 99.7 (100) |
| R merge (%) | 3.8 (42.5) | 7.2 (45.9) |
| I/σ | 73.0 (6.7) | 55.9 (5.3) |
| Refinement statistics | ||
| resolution range (Å) | 33.38 - 1.42 (1.53 - 1.42) |
33.05 - 1.40 (1.51 - 1.40) |
| no. of solvent atoms | 72 | 63 |
| rms deviation from ideal values | ||
| bond length (Å) | 0.004 | 0.009 |
| bond angles (deg) | 0.634 | 0.889 |
| R factor (%) | 17.97 | 18.08 |
| R free (%) | 18.67 | 20.63 |
| Ramachandran plot | ||
| favored/allowed/outlier (%) | 98.3/1.7/0 | 98.3/1.7/0 |
結果および考察:
茶褐色を示す aquayamycin を EnvZ-DHp 結晶に対してソーキングしたところ、図2に示すように、無色透明であった結晶が徐々に着色し、44時間後には濃い茶褐色を呈した。結晶周囲の溶液よりも濃いことから、結晶に aquayamycin が集積していることが予測された。そこで、ソーキング後、20時間後および44時間後の複数の結晶に関して、X線回折データを収集した。分子置換法によって位相決定し、電子密度マップ上で aquayamycin の結合部位を探索した。非対称単位中には1分子の EnvZ-DHp が含まれ、結晶学的な対称性によって、二量体を形成していた。しかしながら、いずれの結晶においても aquayamycin と考えられる電子密度は得られなかった。1例として、10 mM aquayamycin で44時間ソーキングした結晶の結果を表1、図3に示す。複合体を得られなかった大きな理由として、まず aquayamycin の親和性が EnvZ との複合体状態を得るには、まだ十分に高くない可能性があげられる(特に、クライオ結晶化バッファーの溶液条件において)。ソーキングにより結晶へ aquayamycin が集積したのは、非特異的な相互作用によるものと考えられた。また、Ser242、Asp244、および Thr247 への変異導入によって、EnvZ の aquayamycin に対する IC50 値が60から70倍に増大するため、aquayamycin の結合部位はこれらの残基の近傍にあることが予測されている(図3)[5]。これらの領域は H-box 領域の一部であり、自己リン酸化される His243 にも近接している。その一方で、結晶中で隣接した EnvZ-DHp 分子との接触面にも近い(図3)。すなわち、aquayamycin の結合部位が、周囲の EnvZ-DHp 分子によって遮蔽されて、その結合が阻害されている可能性も高いものと考えられる。
図2. Aquayamycin でソーキングした EnvZ-DHp 結晶
図3. 10 mM aquayamycin で44時間ソーキングした EnvZ-DHp 結晶構造の電子密度マップ
H-box 領域のうち Ser242、Asp244、および Thr247 をマゼンタで、自己リン酸化 His243 をシアンで示した。また、結晶内で EnvZ-DHp 隣接する分子をグレーで示した。2Fo-Fc 電子密度マップは 2σレベルで表示した。左:全体構造、右:H-box 領域の拡大図。
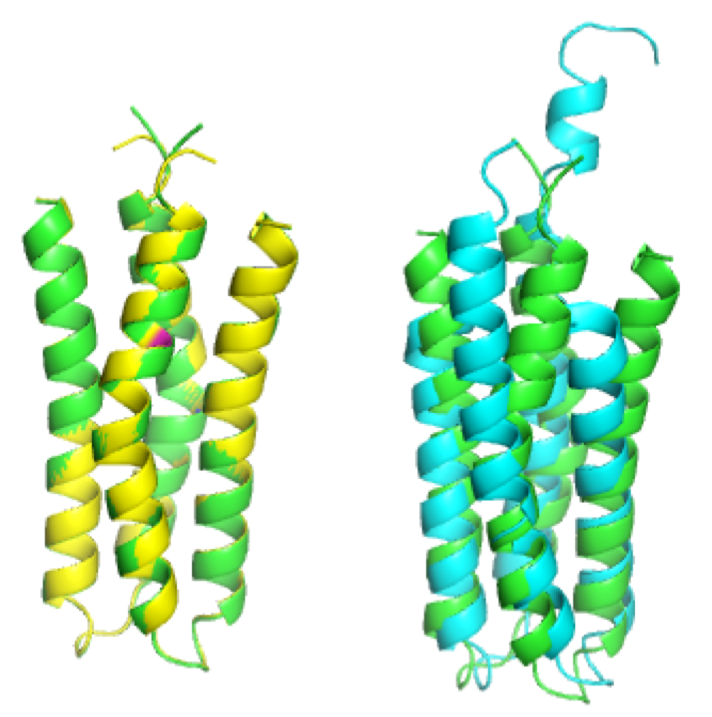
これとは別に、waldiomycin や aquayamycin に対して IC50 値が増大し、親和性が著しく低下した S242A 変異型 EnvZ-DHp [5]の構造解析も行った。その結果、野生型 EnvZ-DHp (PDB ID: 5B1N)と比較して、変異導入部位を除いて主鎖構造に大きな構造変化は認められなかった (図4)。CA 原子の r.m.s.d.は 0.65Å であった。すなわち、この結果は、Ser242 側鎖と waldiomycin との相互作用(水素結合)が重要であることを示し、現在の結合モデルの妥当性を支持している。これらの結果は、主鎖の構造の変化によって親和性を著しく低下させた P248A 変異体 (PDB ID: 5B1O)と対照的であった (野生型との CA 原子のr.m.s.d. = 2.10 Å) [5]。
図4. EnvZ-DHp ドメインの野生型および変異型の主鎖構造比較
左:野生型(緑)と S242A 変異型(黄色)の重ね合わせ。変異導入部位をマゼンタで表示した。
右:野生型(緑)および P248A 変異型(シアン)の重ね合わせ。
今後の課題:
結晶ソーキングによって waldiomycin あるいは aquayamycin の複合体構造を得るためには、EnvZ-DHp 結晶における隣接分子との接触を部分的にも解消して、これらの化合物が結合する必要があるのかもしれない。しかしながら、今回の結果から、aquayamycin には EnvZ-DHp 同士の相互作用を解消するほどの強い親和性には欠けることが明らかとなった。また、waldiomycin あるいは aquayamycin の EnvZ-DHp に対する親和性の低さも要因のひとつとしてあげられる。今後は、複合体状態を調製したのちに共結晶化を試み、さらに両化合物の誘導体化による親和性あるいは溶解性の改良などを総合的に検討していく必要があるものと考えられる。
参考文献:
[1] R. Utsumi in “Bacterial signal transduction: networks and drug targets”, R. Utsumi, ed., Springer, New York, 2008.
[2] Y. Gotoh et al., Curr. Opin. Microbiol., 13, 232 (2010).
[3] 岡島俊英 他、化学と生物、57、416 (2019).
[4] M. Igarashi et al., J. Antibiot. (Tokyo), 66, 459 (2013).
[5] Y. Eguchi et al., J. Antibiot. (Tokyo), 70, 251 (2017).
(Received: September 17, 2019; Early edition: November 28, 2019; Accepted: December 16, 2019; Published: January 22, 2020)