Volume8 No.1
SPring-8 Section A: Scientific Research Report
微小領域FT-IR分析による細胞単位微生物ドメイン識別―海底下生命圏構成生物種の迅速判別と海底下堆積物中の生物特異的シグナルの探索
Domain-level Single Cell Identification of Prokaryotic Cells by Micro-FTIR Spectroscopy –Application to Subseafloor Biosphere and Exploration of Life-specific Signal in Natural Sediment Samples
a(国研)海洋研究開発機構, b高知大学, c(公財)高輝度光科学研究センター
aJAMSTEC, bKochi University, cJASRI
- Abstract
-
本研究では SPring-8 の高空間分解赤外顕微分光装置を利用した非破壊アプローチによる微生物のドメイン情報取得を行うことを目指した。大腸菌、およびメタン生成菌を標準試料とした分析を実施したところ、微生物細胞が複数集積した箇所では安定した測定結果が得られたものの、細胞密度の低いところでは結果のばらつきが大きく、ドメイン判定が困難であった。
Keywords: 赤外顕微分光、海底下生命圏、ドメイン識別
背景と研究目的:
地球表面積の7割を占める海洋、その下に広がる海底下には、現在までに海底下 2.5 km の深さまで生命が存在することが確認されており、地球に存在する全生命体炭素の数〜10%を構成するほど大量の生命が存在していると考えられている [1]。一方で、リボソーム RNA 遺伝子配列による分子系統学的解析によると、海底下には現在の技術では分離‧培養に至っていない多くの未知系統微生物群が優占種として存在することが明らかとなっている[2]。海底下に広がる生命圏は、全地球規模での元素循環や海底下資源の生成、分解など、環境、エネルギーを含む諸分野から注目を集めているものの、実際にどのような微生物がどんな活動を海底下で行っているかについて、生命の最も基本な分類単位であるドメインレベルの構成すら依然として議論が続いている状態である[3]。
筆者らは、安定同位体ラベルした基質を取り込ませた細胞の超高空間分解能二次イオン質量分析(NanoSIMS)を通じて、培養が困難で解析が著しく困難な海底下微生物の生死、またはその極度に低い代謝活性を細胞ごとに観察し、全体の 70% の細胞が少なくとも基質を取り込む能力を有し、大腸菌の10万分の1程度という極めてゆっくりとした代謝を行う生物である事を見出した [4]。しかしながら、微生物細胞内のリボソーム RNA に対して相補的な DNA プローブを吸着させて行う FISH、または酵素で増感を行う CARD-FISH を用いても全体の半数以上は同定不能で、バクテリアかアーキアか、ドメインレベルの群集構成を明らかにすることが出来なかった。このように、海底下に存在し、生命としての機能を有したまま埋もれている微生物の活性は何とか測定できるようになっても、「誰が」それを行っているのか、という点が抜け落ちていた。
一方、Igisu らは非破壊で微生物細胞のドメインを判別する方法を見出した[5]。赤外光の吸収スペクトラムにおいて、バクテリア、アーキア、両ドメインの微生物細胞体は以下の特徴的な吸収バンドを持つ:3300 cm-1(O-H and N-H), 2960 cm-1 (aliphatic CH3: end-methyl), 2925 and 2850 cm-1 (aliphatic CH2: chain-methylene), 1650 cm-1(C = O: amide I), 1540 cm-1 (N-H and C-N: amide II)。このうち aliphatic CH3 (2960 cm-1) と CH2 (2925 cm-1) の吸収比 (R3/2) が同ドメイン中の微生物体では一定で、ドメインが異なると違った値を示すことを Igisu らは見出した。これはそれぞれのドメイン毎に大きく異なる膜脂質の化学組成が寄与しており、非破壊の赤外分光測定を行い、R3/2 を計算することでバクテリアとアーキアを見分けられるということを示している。ただ、Igisu らが用いた方法では、スポット径が最小 10 μm 程度であり、1 μm 程度の微生物細胞を複数同時に分析していた。
そこで本研究では SPring-8 の高空間分解赤外顕微分光装置を利用した非破壊アプローチによる微生物のドメイン情報取得を行うことを考案した。試料台上に分散させた細胞を測定対象とし、高空間分解赤外顕微分光装置によって、数ミクロンのスポットにおいて細胞ごとにバクテリアかアーキアかを判別する。非破壊分析であることから、その後、同一細胞を用いた代謝活性解析や個別遺伝子解析などと組み合わせることで、強固な膜、外壁構造を持つためにこれまで解析の難しかった海底下微生物の生態解明や地球レベルでの元素循環に果たす役割の解明に資する知見を得ることを目指した。
実験:
<試料>
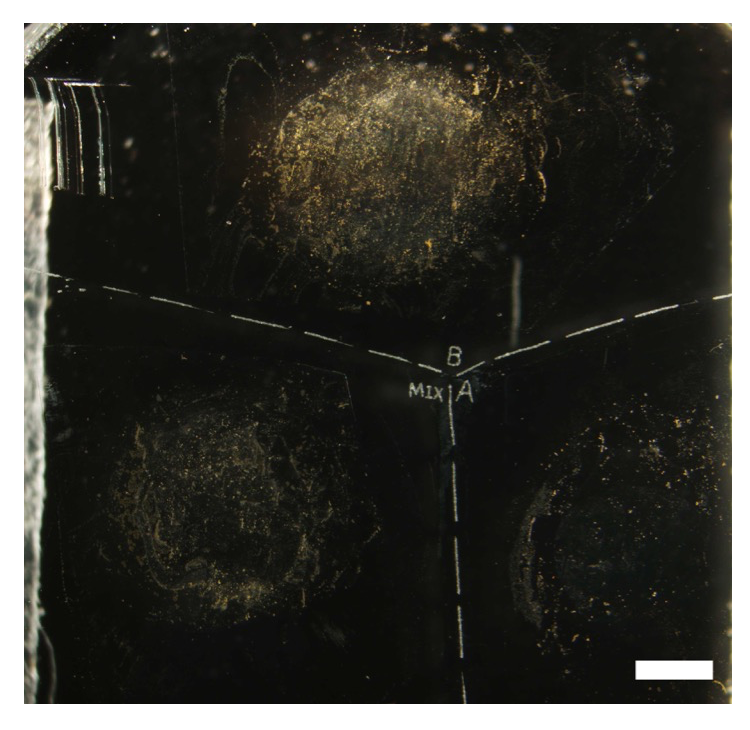
試料の調製にあたっては透過配置での測定のため、フッ化バリウム(BaF2)結晶板、ガラス板に酸化インジウムによる導電性コーティングを施した基板をベースとして使用した。標準試料としてバクテリアは大腸菌 Escherichia coli JM109 株、アーキアはメタン生成菌 Methanoculleus submarinus DSM 15122 を用いた。それぞれの微生物株をホルマリンで固定したのち、ポリカーボネートメンブレンに捕集した。数 mm 角に切断したメンブレンについて、SYBR Green I で染色を行ったもの、未染色のものをそれぞれ準備し、BaF2 結晶またはガラス基板に d-H2O を数 µl 滴下した上に微生物が捕集された側を基板に向けて置き乾燥させ、微生物細胞を基板上に転写することで測定試料とした(図1)。測定試料上では数マイクロメーターの領域で細胞が重なる場所、重なっていない場所を準備し、5000~50000 細胞/cm2 程度の密度で配置した。この他に、下北半島沖海底近傍の堆積物試料から分離した微生物も同様の試料調製を行った。
図1:作成試料の一例、Bar: 100 µm、A:アーキア(メタン生成菌)、B:バクテリア(大腸菌)、MIX:両者の混合
<実験方法,使用装置・実験測定条件>
すべての測定は BL43IR の高空間分解顕微鏡(Bruker Hyperion2000)、および分光光度計 Bruker Vertex70 を使用して実施した。
波数領域は中赤外領域を使用した。Igisu らの測定条件を参考にし、数マイクロメーターの空間領域をターゲットとして、波長分解能を 4-8 cm-1 で主として 4000 から 1000 cm−1 を対象として吸収スペクトルを測定した。積算回数は得られたシグナルの強度を見ながら適宜調整を行った(2000~15000回)。得られたデータから CH 伸縮振動の強度を用いて、微生物の膜脂質成分の違いを反映する aliphatic CH3 (2960 cm-1) と CH2 (2925 cm-1) の吸収比 R3/2 を算出し、バクテリア、アーキアの非破壊区別を実施した。
結果および考察:
まず、標準試料の分析では、バクテリアとしては大腸菌(Escherichia coli JM109)、アーキアとしてはメタン生成菌(Methanococcus submarinus)を基板上に載せた試料を用意し、分析範囲を数 µm の範囲(4-10 µm 四方)として、波数分解能を 4 cm-1、積算回数 2000-6000 回で繰り返し測定を行ったが、CH 伸縮振動に由来するピークを検出することが出来なかった。基板としてはフッ化バリウム、導電性コーティングを施したガラス基板を用いたが、双方で大きな変化は見られなかった。
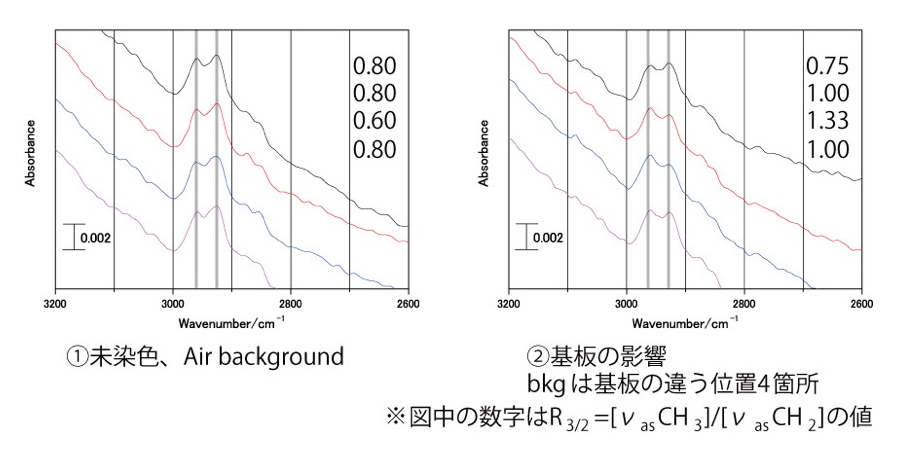
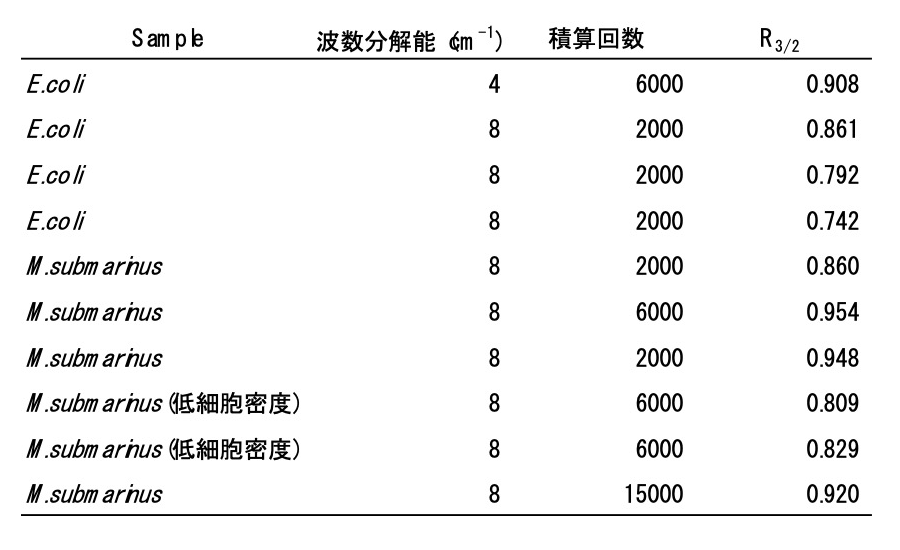
Igisu らの既報では、50 µm 四方で測定を行っていたが、数細胞から20細胞程度で測定が可能であったと述べられていた。本測定においては、数細胞以上の微生物が分析領域に入るように測定を行っていたが、バックグラウンド測定として、同じ基板上の微生物細胞近傍、微生物細胞が存在しない箇所の赤外吸収を測定していた。そこで、大腸菌が濃集している箇所を選び、基板を外した空気、および基板上の微生物が見られない部分、それぞれをバックグラウンドとした測定を実施したところ、R3/2 が大きく変動することが明らかとなった(図2)。これは、試料基板上の微生物が見られない領域にも何らかの有機物質が存在していることを意味していることから、バックグラウンドは試料基板を取り外し、空気による吸収のみを用いることとした。さらに波数分解能を 8 cm-1 とすることでシグナル強度の増加を狙ったところ、既報の R3/2 としてバクテリアを示す 0.6-0.8 程度の範囲に含まれる値 (0.74, 0.79) を得ることが出来た。しかし、例えば、測定点における大腸菌の密度が低い場合や、積算回数が不十分な場合、または、波数分解能が小さい場合においては、R3/2 が高くなる傾向が見られた(表1)一方、アーキアであるメタン生成菌では、R3/2 が 0.9-1 程度となることが予想されたが、測定箇所によりばらつきが多い結果となった。特に、細胞密度が低い場所では R3/2 が低いことが多く、大腸菌の値と近接した値となった。細胞密度に依存した R3/2 のばらつきについては、細胞が存在しない基板上に何らかの有機物が付着しており、その測定結果の寄与度の違いにより起こったものと思われる。一方、赤外吸収スペクトルには、特にメタン生成菌において低シグナル強度に起因するノイズが多く見られた。今回用いたメタン生成菌は菌体サイズが小さく、低積算回数の測定でスペクトルの乱れ(ノイズ)が大きかったことから、R3/2 がばらつく原因になったものと思われる。
図2:大腸菌を測定試料とした際のバックグラウンドによる影響、基板を外した空気をバックグラウンドとした場合(①)と異なり、基板上で微生物が見られない位置(4か所)をバックグラウンドとした場合(②)に R3/2 が大きく変動していることがわかる。
表1:各標準細胞試料における測定とそれに基づく R3/2 の計算結果
また、ビームタイムにおける測定成果を最大化させる意図を持って天然試料の測定も多数行ったが、ビームタイム後の解析で上記標準試料における問題点が存在していたことが明らかとなり、その測定結果の信頼性が低いことが示唆されたため、結果としては記載しないこととした。
今後の課題:
上記のように、標準試料を用いた試行において、複数細胞をターゲットとした分析においても、生物種判別を信頼性高く行うには不十分な結果となった。この要因としては、試料調製時の問題、および測定におけるシグナル強度の問題など、複数の問題が存在していることが示唆された。また、吸収スペクトル測定において、試料調製時に起こるコンタミネーションの危険性や測定へのリスク等、課題申請時には正しく認識できていなかった注意点に配慮した試料調製法を考案することの重要性を認識した。
海底下生命圏は、培養細胞よりもサイズの小さい細胞で構成されている。単一細胞をターゲットとする場合には、必然的に分析範囲に細胞を含まない基板部分が多く含まれる。まずはこのバックグラウンドを低下させ、シグナル/ノイズ比を向上させていくことが、測定を成功させるために必要不可欠な第一義的な課題である。今回の実験では、波長分解能を調整し、積算回数を増やしても、安定した結果を得るためには複数の細胞が含まれるような形で測定を実施する必要があった。一方、細胞が少数しか含まれない測定の場合では、細胞以外の場所に存在すると思われる有機物シグナルが問題であったが、その点は試料調製段階で基板を高度に清浄化したり、細胞をマウントする方法を工夫するなどして対応が可能であることが考えられた。一方で、細胞がそもそも微小のために数万回を超える積算、数時間以上の測定を行っても、ノイズを超える有意なデータを得ることが困難であることも示唆された。結論として、目的としていたシングルセルレベルでの測定を実現することは、現在の試料調製技術、装置構成では現実的な目標設定とは言えないと結論した。
参考文献:
[1] Parkes et al. Hydrogeol J. 8, 11-28 (2000)
[2] Inagaki et al. PNAS 103, 2815-20 (2006)
[3] Lipp, Morono et al. Nature 454, 991-4 (2008)
[4] Morono et al. PNAS 108, 18295-300 (2011)
[5] Igisu et al. Environ. Microbiol. Rep. 4, 42-49 (2012)
(Received: August 16, 2019; Early edition: September 30, 2019; Accepted: December 16, 2019; Published: January 22, 2020)