Volume7 No.2
SPring-8 Section A: Scientific Research Report
高温高圧下の水の構造
Structural Study of Water under Pressure at High Temperature
a(国研)量子科学技術研究開発機構, bロシア科学アカデミー高圧物理学研究所
a National Institutes for Quantum and Radiological Science and Technology,
b Institute for High Pressure Physics, Russian Academy of Sciences
- Abstract
-
水の構造の温度変化を調べるため、高温高圧下での水のX線回折実験を行った。温度 1273 K で、常温常圧の水とほぼ同じとなる条件での測定に成功した。温度 1273 K での水の構造は、常温常圧とは大きく異なるが、673 K での構造からの変化は小さいことが明らかになった。
Keywords: Water、Liquid、Structure
背景と研究目的:
液体の水は特異な性質を持つことが知られている[1]。例えば、一般の液体は温度と共に膨張するのに対し、水は 0℃ から 4℃ の間で温度と共に体積が収縮する。また、水は同程度の分子量の分子性液体と比較して高い沸点を持つ。これらの性質は、水分子の間に方向性を持つ水素結合が形成されること、そのため液体中の分子配列に固体の氷に似た秩序が残ることに関係していると考えられている。実際、単原子分子のように分子を剛体球で近似できるような単純な液体では、一つの分子の周りに存在する最近接分子の数(配位数)は10以上であるが、水の場合の配位数は4から5個程度と少なく、常圧での氷の配位数4とほとんど変わらない。このような水の構造は温度や圧力によって大きく変化する。我々は、これまで高温高圧放射光その場X線回折測定により融点直上の水の構造を 17 GPa までの高圧下で調べ、約 4 GPa までは、最近接の水分子間の距離はほとんど変化せず、配位数が10程度まで急激に増加するのに対し、それ以上の圧力では、配位数は一定となり水分子間の距離が減少することを見出した[2]。一方、より広い温度・圧力範囲で行われた第一原理分子動力学法による研究では、このような配位数の増加を伴う構造変化は、密度一定の条件で 700 K 程度まで温度を上げることによっても起きることが示された[3]。同時に行われた我々の高温高圧放射光その場X線回折測定でもこの結果は確かめられた[3]。これらの研究は、高温では水素結合が安定に形成されなくなり、氷に似た近距離秩序が消失することを示している。さらに高温高圧の数千Kあるいは数百 GPa といった極端条件下では、水はイオン液体や金属液体に変化することが予測されており[4]、物性研究、惑星科学研究の立場から理論・実験両面で研究が進められている。本研究では、我々が用いている実験方法による温度のほぼ上限と思われる 1273 K まで、常温常圧の水とほぼ同じ密度での測定を行い、大きな変化が観測されるかどうかを調べた。
実験:
放射光X線回折その場測定は、BL14B1に設置されているキュービック型マルチアンビルプレス装置を用いて行った。圧力発生は、先端 6 mm 角のタングステンカーバイド製のアンビルと 9 mm 角のボロンとエポキシ樹脂混合物の圧媒体を組み合わせて行った。加熱は圧媒体内のチューブ型のグラファイト製ヒーターで行った。試料容器には単結晶ダイヤモンド製の外径 2.5 mm、内径 1.5 mm、深さ 1.6 mm カップ、フタには金の円盤を用いた。試料として市販の純水を用いた。温度は投入した電力から見積もった。電力と温度の関係は、同様の試料セルに熱電対を入れて行った予備実験により決定した。内部圧力マーカーとしては NaCl と BN の混合物を用い、NaCl の格子定数をX線回折により測定して NaCl の状態方程式[5]と比較することにより圧力を算出した。水の密度は、水の状態方程式 IAPWS-95 [6]を用いて見積もり、密度が 1.0 g/cm3 程度になるように圧力を制御した。X線回折は、白色X線と Ge 半導体検出器(SSD)を用いたエネルギー分散法で測定した。広い波数範囲の構造因子 S(Q) を得るために、回折角 2θ を 4° から 20° の範囲で、2° おきに変化させて測定を行った。S(Q) は、回折角を変えて測定した一そろいのデータから経験的な方法で導いた[7]。解析には分子形状因子を用いた[8]。解析の条件は過去の研究[2]の条件にそろえた。
結果および考察:
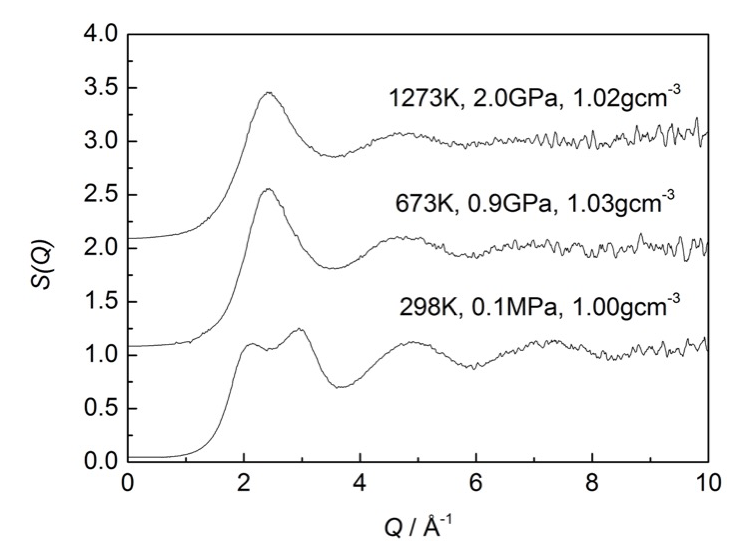
図1に 1273 K での水の構造因子 S(Q) を 298 K [2]、673 K での S(Q) とともに示す。密度がほぼ 1.00 gcm-3 になるように、圧力はそれぞれ 2.0 GPa、0.1 MPa、0.9 GPa、で測定した。単純な液体の S(Q) は、大きな第1ピークのあとに振動構造が減衰しながら続く形を示すが、常温常圧の水の場合は、最初の極大の後に、はじめの極大より大きな極大が近接して現れ、あたかも第1ピークが二つに分裂したかのような特徴的な形を示す。この特徴は、673 K ですでに消失しており、単純な液体で見られる形に変化する。1273 K の S(Q) は、673 K の S(Q) とほとんど変わりがないが、わずかに第一ピークの高さが低くなるとともに、それに続く振動も小さくなっている。
図1.密度をほぼ 1.0 gcm-3 に保った条件での水の構造因子 S(Q) の温度変化
図2に S(Q) をフーリエ変換することによって得られる2体分布関数 g(r) を示す。これは、一つの水分子から距離 r だけ離れたところに他の水分子がどれくらい存在するかを示すものである。距離の小さいところで顕著にみられるように短い周期のリップルがあるが、これは S(Q) の波数範囲が限られていることや S(Q) のノイズによる見せかけのものである。これらのリップルを除外して考えた場合、常温常圧の水では、最初の極大は約 2.85 Å にあり、第2の極大は約 4.5 Å にある。673 K では、最初の極大は約 3.0 Å と少し遠距離に移動する一方、2番目の極大は 6 Å に近いところまで移動している。このため常温常圧で第2の極大があった距離でほぼ極小となっている。このように、最初の極大の位置と2番目の極大の位置の比が大きく変化することは、常温常圧の水で存在していた水素結合の形成による氷に似た秩序が消失したことを示している[3]。一方、1273 K での g(r) は、基本的には 673 K での g(r) と同じである。違いとしては、第一ピークの高さがわずかに小さくなっていることが見て取れる。これは、温度が上がったことにより分子の運動が激しくなり、分子間の位置の揺らぎが大きくなっていることを表していると考えられる。
図2.密度をほぼ 1.0 gcm-3 に保った条件での水の2体分布関数 g(r) の温度変化
今回の結果から、常温常圧の水で見られる特徴的な構造は、673 K ですでに消失しており、1273 K まで温度を上げてもそれ以上の変化はほとんどないことが分かった。これは、水素結合の影響が消失した後の次の段階の変化、例えば、イオン液体への変化が起きると予測されている領域がより高温高圧であることと矛盾しない[4]。
今後の課題:
分子乖離などの変化が起こっていないことを確実に示すには、経験的な分子間力を使った古典的な分子動力学シミュレーションを、温度を変えて行い、実験と比較することが有効である。さらに高温高圧で予測される次の段階の変化を観測するためには、温度・圧力領域を大幅に拡張する新しい実験手法の開発が必要である。一方、673 K までに起きる水素結合の影響が消失する過程をより詳しく調べるためには、水素の位置情報を得ることができないX線回折実験だけでは不十分であり、水素-水素および水素-酸素の相関を調べることができる中性子回折実験が必要となる。現在、進められている高温高圧下の中性子回折実験手法の開発においては、目的を水素結合の水の構造に及ぼす影響を調べることとした場合、1 GPa、673 K 程度を目標とすることが妥当である。
参考文献:
[1] D. Eisenberg and W. Kauzmann, The Structure and Properties of Water (Oxford University Press, New York, 1969).
[2] Y. Katayama et al., Phys. Rev. B 81, 014109 (2010).
[3] T. Ikeda et al., J. Chem. Phys. 132, 121102 (2010).
[4] C. Cavazzoni et al., Scinece 283, 44 (1999).
[5] D. L. Decker, J. Appl. Phys. 36, 157 (1965).
[6] W. Wagner and A. Pruss, J. Phys. Chem. Ref. Data 31, 387 (2002).
[7] K. Tsuji et al., Rev. Sci. Instrum. 60, 2425 (1989).
[8] F. Hajdu, Acta Crystallogr., Sect. A, 28, 250 (1972).
(Received: April 1, 2019; Early edition: July 8, 2019; Accepted: July 16, 2019; Published: August 29, 2019)