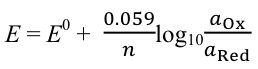Volume7 No.2
SPring-8 Section A: Scientific Research Report
高度好熱菌由来の銅含有亜硝酸還元酵素の構造と機能的洞察
Structure and Functional Insights for the Thermus Copper Nitrite Reductase
大阪大学大学院理学研究科
Graduate School of Science, Osaka University
- Abstract
-
窒素は地球上の生命にとって必須元素であり、その自然界での循環を分子レベルで理解することは意義深い。最近の全ゲノム解析により、新たな高度好熱菌のゲノム上に新奇な銅含有亜硝酸酸還元酵素が見つかった。本実験では、その構造遺伝子に着目し、そのタンパク質について結晶構造解析と簡単な生化学的解析を行い、その機能について考察した。
Keywords: 金属酵素、銅蛋白質、マルチドメイン、酸化還元
背景と研究目的:
窒素は地球上の生命にとって必須の元素であり、生物学的または無生物学的作用を介して様々な化学物質に姿を変え、自然界を循環している。その窒素循環において、水中や土壌中の窒素酸化物(NOx)は微生物の働きによる段階的な還元を経て分子状の窒素(N2)にまで変換され、大気中へと放出される(NO3- → NO2- → NO → N2O → N2)。この過程は“脱窒”と呼ばれ、各還元段階は細菌(脱窒菌)が持つ特有の酵素群によって触媒される[1]。
最近、Thermus oshimai JL-2 という新たな高度好熱性脱窒菌が同定され、その全ゲノム解析が行われた[2]。興味深い事に、そのゲノム配列中の脱窒に関連する酵素群のうち、銅イオンを持つ既知の亜硝酸還元酵素(CuNIR)(図1)と似ているがその推定分子量が約 1.5 倍大きい(アミノ酸数が既知のものより多い)未知のタンパク質を発見した。そこで本研究では、このタンパク質が銅イオンを持ちうるのか、そして、もし持つのであれば、そのタンパク質内での銅結合部位はどういった構造をしているのか、さらには,そのタンパク質が酵素として働きうるのかを調べることを目的とした。
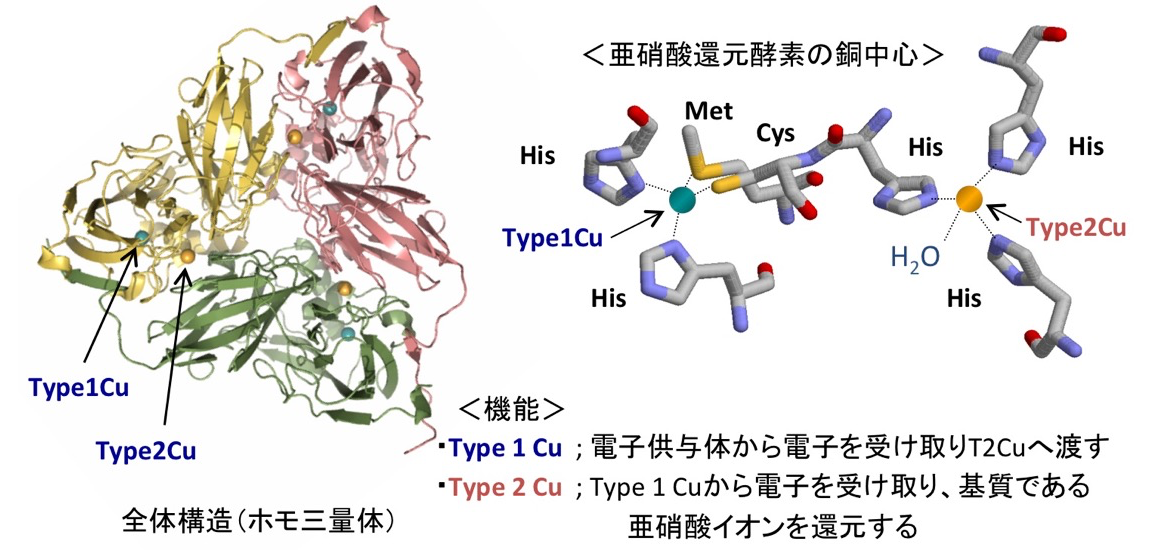
図1. 一般的な CuNIR の全体構造と銅結合部位。基質である亜硝酸イオン(NO2-)を1電子と2プロトンを用いて NO を生成する反応(NO2- + e- + 2H+ → NO + H2O)を触媒する。"T2Cu" は Type2Cu を意味する。
実験:
構造解析
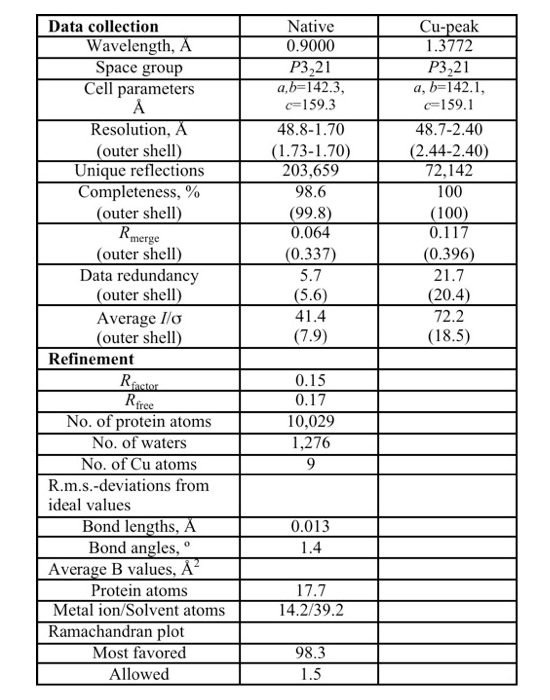
目的のタンパク質は、ゲノム配列情報(locus_tag: Theos_1053)をもとに人工的に遺伝子合成を行い、大腸菌を用いた発現系において組換え体として調製した。本タンパク質の構造解析にはX線結晶構造解析法を用い、調製タンパク質の結晶化(図2)ならびに大型放射光施設SPring-8蛋白研ビームラインBL44XUにて回折実験を行った。銅のピーク波長(1.3772 Å)ならびにNativeデータとして波長 0.9 Å のX線を用いて、各々 2.4 Å と 1.7 Å の回折データを得た。単一波長異常分散法により初期位相の決定を行い、続いて Refmac により構造精密化を行い、最終的に R 因子値が ~20% 程に到達したところで精密化を終了した。各々の回折データおよび精密化統計値を表1に示す。分子表面のループ部分に位置する Ala289(Chain A)、Ala289(Chain C)、そして Gly343(Chain B) が Ramanchandran Plot で disallowed region(0.2%)にあったが、電子密度が若干浅く修正が困難なため、特に修正を加えず現状維持とした。
図2. Thermus CuNIR 結晶
表1. X線回折実験データおよび構造精密化統計値
活性測定
メチルビオロゲンカチオンラジカルを人工電子供与体として用い、本タンパク質の亜硝酸還元活性測定を行った.反応はメチルビオロゲンカチオンラジカルの吸収の減少を追うことでモニターした。単位時間あたりの吸光度の変化から触媒回転効率を示す kcat を算出した。
酸化還元滴定
本タンパク質の酸化型をフェリシアン化カリウム存在下で調製し、そこに少量ずつ還元剤であるジチオナイトを加え、還元していったときの Type1Cu に由来する波長 600 nm の吸光度を測定した。溶液中の還元型濃度(%)と溶液電位の関係をプロットしネルンスト式により解析した。
結果と考察:
1. 構造解析
1-1 全体構造
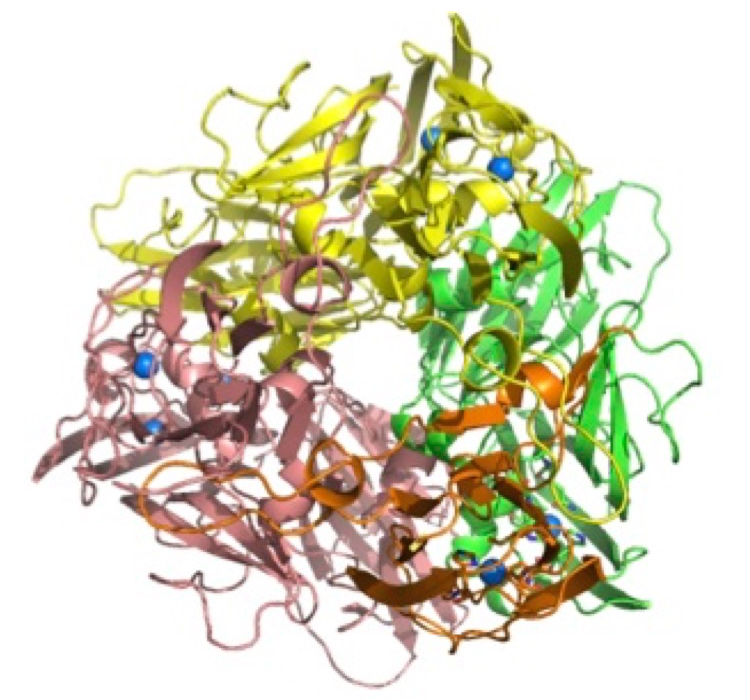
X線結晶構造解析から決定した本タンパク質の全体構造を図3に示す。本タンパク質は同一のサブユニット3つからなるホモ3量体構造をしており、既知の亜硝酸還元酵素と同様にその分子内に疑似3回対称軸が存在した。また、1つのサブユニットごとに3つの銅結合部位があることが分かった。
図3. Thermus CuNIR 全体 サブユニットで色分けしている(黄色、肌色、緑)
1-2 サブユニット構造
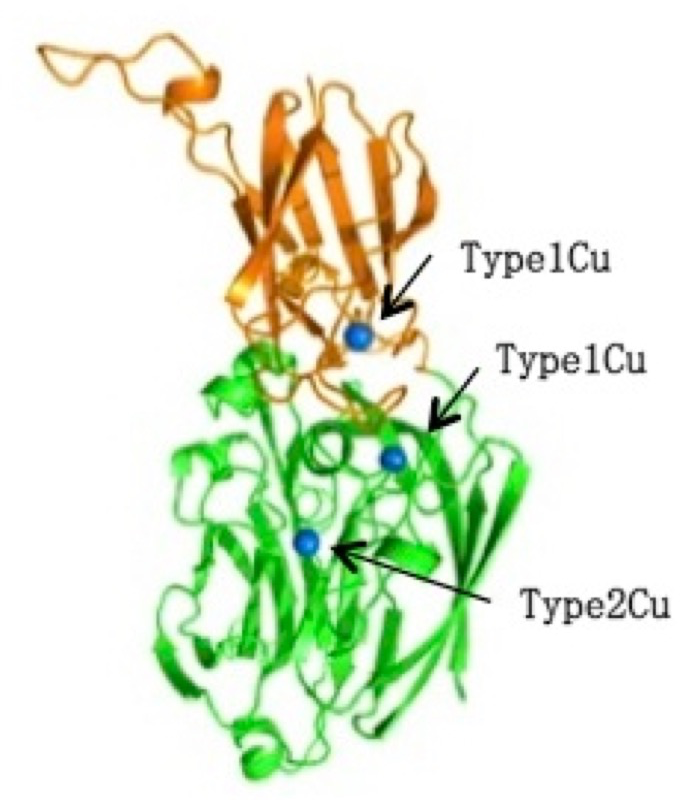
1つのサブユニットについてさらに詳しく調べた.本タンパク質の1つのサブユニットは新奇性のあるC末端側のドメインの2つに分けて考えることができる(図4)。結晶構造解析により、この C 末端側ドメインは NIR ドメインの Type1Cu 部位上部に位置していることが分かった。さらに、サブユニット1つごとに3つの銅結合部位が確認でき、そのうち2個は NIR ドメインに、残りの1個は C 末端側ドメインにあることが分かった。以下、それぞれの銅結合部位について概略のみ述べる。
図4. Thermus CuNIR モノマー 緑色が NIR ドメイン、茶色が C 末端ドメインを示す。
<NIR ドメインにおける Type1Cu>
一般的に銅含有亜硝酸還元酵素の Type1Cu は4つのアミノ酸残基が配位しており、それらは、2つのヒスチジンと、システイン、メチオニンである。しかし、興味深い事に本タンパク質の NIR ドメインの Type1Cu は、その配位アミノ酸の1つであるメチオニンがアスパラギンになっていた。
<NIR ドメインにおける Type2Cu>
一般的な亜硝酸還元酵素における Type2Cu は3つのヒスチジン残基に配位され、Cu 近傍には亜硝酸還元に必須であるとされているアスパラギン酸が存在する。しかし本タンパク質においてはアスパラギン酸が存在するべきところにセリンが存在していた。
<C末端側ドメインにおけるType1Cu>
アミノ酸残基の空間的配置は多少異なるものの、一般的な Type1Cu と同一であった。
2. 酵素活性測定
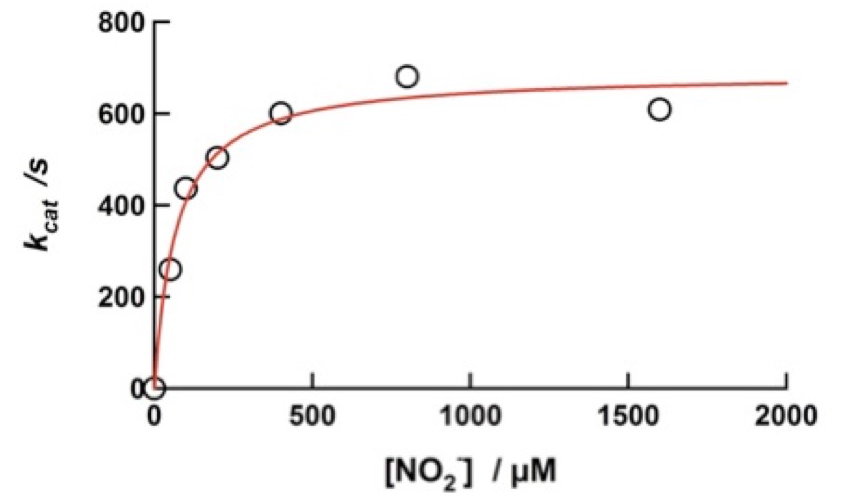
今回は本タンパク質が亜硝酸イオンを還元する反応速度を分光学的手法で計測するため、人工電子供与体であるメチルビオロゲンラジカル(ε600 = 13.7 mM-1cm-1)を加え、反応が進んだ際のメチオビオロゲンラジカル由来の 600 nm 付近の吸光度の減少を追った。それぞれの亜硝酸濃度ごとに単位時間あたりの吸収変化(ΔAbs)から初速度 v を求め、さらに触媒回転効率を示す kcat を算出した。最終的に Vmax に相当する kcat は 688 ± 30 s-1 と見積もられ、本タンパク質が亜硝酸イオンを還元するために十分な活性を持っていることが分かった(図5)。
図5. 触媒活性の基質濃度依存性 (嫌気下, 25℃)
今回の測定から本タンパク質が十分に亜硝酸還元活性を持つことが分かった。では、酵素が働く際に3つの銅結合部位においてどのように電子の伝達が起こっているのだろうか。本タンパク質分子内部の電子の移動経路について洞察するために、次に酸化還元滴定実験を行った。
3. 酸化還元滴定
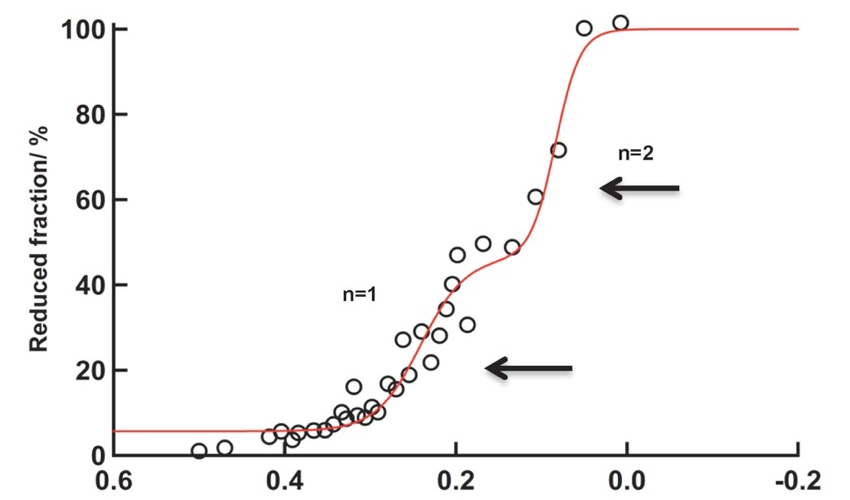
本タンパク質の酸化型をまず酸化剤であるフェリシアン化カリウム存在下で調製し、そこに少しずつ還元剤としてジチオナイトを加えていくことで還元していった際の、波長 600 nm 付近の吸収(本タンパク質の Type1Cu に由来する)の減少をプロットしていった(図6)。
図6. 酸化還元滴定
図6に見られるように二段階の還元様式が確認された.この曲線をさらに以下のネルンストの式で解析した。
ここで n :電子移動数、E0 :標準電極電位、a :酸化型、還元型それぞれの活量である。
すると、E = +96 mV においては n=2 で、E = +251 mV においては n=1 で解釈することができた。測定前の初期状態で Type1Cu、Type2Cu 部位が酸化状態で、NIR ドメインの Type1Cu が還元されると Type2Cu に電子が伝達され、Type2Cu が還元状態、Type1Cu が酸化状態になる。酸化状態になった Type1Cu が再び還元されるので、NIR ドメインの Type1Cu の還元滴定カーブが n=2 になったと考えられる。もう1つの n=1 の方が、おそらく C 末端側ドメインの Type1Cu であると結論づけられた。
まとめと今後の課題
今回の研究により、T. oshimai 菌が持つ銅含有亜硝酸還元酵素には、既知のものと比べそのC末側に新奇なドメイン構造を持つ事が分かった。さらに、そのドメインに典型的な Type1Cu が存在することがわかった。暫定的な酸化還元滴定実験から、C 末端側のドメインの Type1Cu (Em = +251 mV)が NIR ドメインの Type1Cu (Em = +96 mV)へ電子を渡すことは熱力学的にも難しいと考えられる。つまり、C 末端側のドメインの Type1Cu は亜硝酸還元に直接には関与しないのではないかと考えられる。しかし、今回の新奇な亜硝酸還元酵素は既知の NIR と同等の酵素活性を示す。では C 末端側ドメインはどのような理由で付いているのだろうか。この疑問については、今回の実験のみでは明らかにすることは出来ない.今後のさらなる解析により解決されるべき課題の1つであろう。
参考文献:
[1] W. G. Zumft, Microbiol. Mol. Biol. Rev., 61, 533 (1997).
[2] S. K. Murugapiran et al., Stand. Genomic Sci., 7, 449 (2013).
(Received: March 30, 2019; Early edition: June 27, 2019; Accepted: July 16, 2019; Published: August 29, 2019)