Volume7 No.2
SPring-8 Section A: Scientific Research ReportP
酸化還元酵素における分子間電子移動メカニズムの解析:金属活性中心幾何構造の制約起源に関わる構造基盤
Analysis of Intramolecular Electron Transfer on the Redox Enzymes: Structural Basis for Origin of the Geometrical Constrain for the Metal Centers
大阪大学大学院理学研究科
Graduate School of Science, Osaka University
- Abstract
-
酸化還元酵素の中でもその活性中心に金属を持つものは、その配位幾何構造ならびに触媒反応場を最適なものへと形作っていると考えられている。本実験では、その概念を実験的に証明するべく異種金属原子で置換を試み、その配位幾何構造がどのように変わるかをX線結晶構造解析から確認し、その剛直性ならびに多様性について機能的側面から考察した。
Keywords: 金属酵素、エンタティック、配位子場
背景と研究目的:
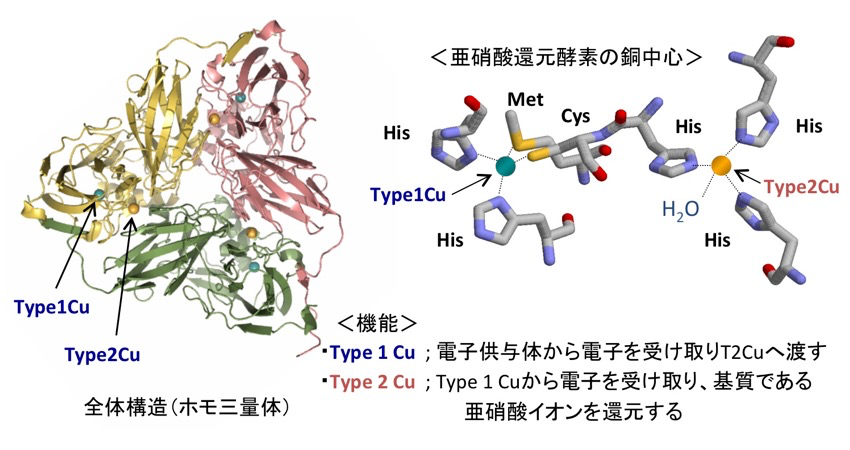
一般に、金属を保持したタンパク質の分子内部に見られる「金属結合部位(活性中心)」は、そのタンパク質が生体中で定められた機能を発揮するために最適な幾何学構造をとっていると考えられている。この概念は、1968年に初めて Prof. R. J. P. Williams によって “エンタティック(entatic)”* という言葉を用いて提案され[1]、今もなお、酵素や触媒化学等の分野で幅広く引用・支持され続けている。一方、20種類のアミノ酸が数百〜千個繋がったポリペプチド鎖から成るタンパク質では、その独特の折り畳まれ方に応じて、局所的に強固な立体構造を保持する領域や、比較的、変化を起こし易い “柔らかい” 部分などを併せ持つ構造的性質を有する。そのため、タンパク質分子内部で「どういった配位環境が特別な活性金属中心(構造)を生み出す要素となるか」について定義することは一般に難しいとされる。そこで、本研究では “エンタティック” に関わるタンパク質の立体構造情報を実験的に得るために、これまでよく知られている銅含有亜硝酸還元酵素(CuNiR(図1))を材料として用い、その “エンタティック” な部位としての2種類の銅結合部位(タイプ-1および-2銅部位)を異種金属イオンで置換し、その時にどのような構造的差異が生じるか調べることを目的とした。著者らはこれまでに様々な酸化還元金属酵素の分子間電子伝達について研究を継続しており[2,3]、本研究から得られる基礎データは、それら分子間電子伝達機構解明の一助になると期待される。
図1. CuNiRの全体構造と銅結合部位。基質である亜硝酸イオン(NO2-)を1電子と2プロトンを用いて NO を生成する反応(NO2- + e- + 2H+ → NO + H2O)を触媒する。
実験:
銅以外の金属を含む金属置換体タンパク質は、N 末端に 6xHis タグを導入した亜硝酸還元酵素を遺伝子工学的に作成し大腸菌での発現系を用いて発現させ、Ni-NTA アフィニティーカラムクロマトグラフィーで精製したものを用いた。精製後の試料は 50 mM EDTA を含む中性緩衝液中に一週間以上漬けることで金属を含まないアポ型タンパク質として調製し、その試料に対し各種金属(M2+: Co, Ni, Zn)イオンを含む緩衝液で透析する(4℃ で一週間)ことで各金属置換体を調製した。続いて、過剰な M2+ イオンを除去後、各金属置換体タンパク質の結晶化とX線回折実験を行った。X線回折実験は大型放射光施設SPring-8蛋白研ビームラインBL44XUにて実施した。各々の回折データおよび構造精密化統計値を表1に示す。分子置換法により初期位相の決定および Refmac による構造精密化を行い、最終的に R 因子値が〜20% 程に到達したところで精密化を終了した。Zn に置換した試料についてはタイプ-1銅部位およびタイプ-2銅部位が Zn に置換された構造は確認できたが、分子表面の所々に不明瞭かつ解釈不能な電子密度が多く見られ、今回は精密化途中の段階で断念することとし、参考データ程度として扱うことのみにした。
表1. 各金属置換体のX線回折実験データおよび構造精密化統計値
結果と考察:
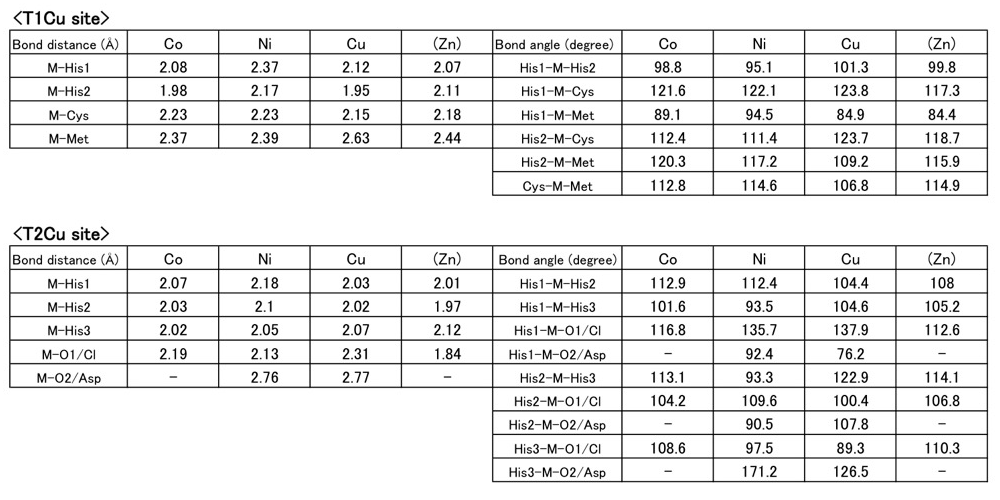
X線回折実験からタイプ-1銅および-2銅部位が Co と Ni に置換された2構造を決定することができた。各々の結合距離、角度を天然のもの(Cu)も含めて比較・検討したところ主に次の興味深い傾向を観測できた。両部位の結合距離および角度は表2に示されている。
表2.タイプ-1およびタイプ-2銅部位の結合距離および角度
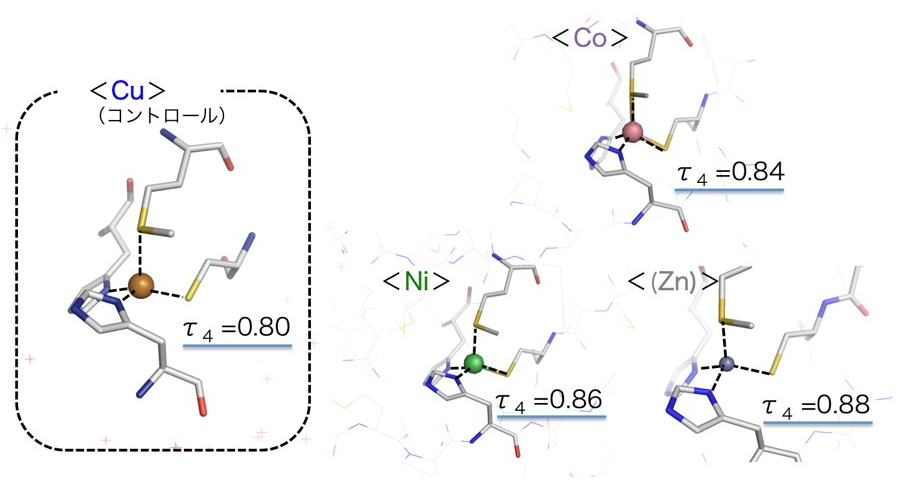
①タイプ-1銅部位の幾何学構造は異種金属を挿入してもその変化は小さく、四面体〜三方錐形を強固に維持したままだった(表2および図2)。
図2. タイプ-1銅部位の構造。
4配位幾何構造の指標として τ4 = 360°-(α+β)/ 141°[4]を用いて解析を行った。αとβはその配位構造を形成している結合角の最も大きい角度とその次に大きい角度を指す。この τ4 値が1に近ければ近いほど理想的な四面体幾何構造を意味し、0 に近ければ平面四角形を意味する。結果、いずれの金属置換体においても τ4 = 0.8〜0.9 内(三方錐)に収まっていた。これは、もともと平面四配位構造を好む Cu2+(d 軌道電子数9)イオンが蛋白質分子内部では異常な四面体〜三方錐の幾何学構造をとっていることからも予測されていたように、周りの配位アミノ酸の立体的な配置(構造)が非常に剛直であるため、d 軌道電子数の違い( = 金属種の違い)から生じる配位特性の影響が出難い原子環境にある(強制的に配位構造を歪ませている)ことを意味し、今回その明確な実験的証拠を得る事に成功したことになる。興味深いことに、これまでにタイプ-1銅を保持するタンパク質で同様の金属置換を実施した報告もある。例えば、アズリンやアミシアニンというタイプ-1銅含有タンパク質では、銅部位を Co や Ni に置換すると配位していたメチオニン残基が外れることがX線結晶構造解析結果から報告されている[5-7]。しかしながら、その配位子脱離は溶液中では見られず、逆にメチオニン残基と異種金属間の相互作用(近づく)が強まるという結果が常磁性 NMR 分光測定から証明されている[8,9]。さらには、シュードアズリンというまた他のタイプ-1銅含有タンパク質を Co 置換した実験では、銅が結合していたときよりも配位結合距離が縮まる結果も得られており[9]、本研究の結果ともよく合う。また、生体内でのタイプ-1銅部位の主な機能は、酸化還元パートナー分子から電子を受け取り、その受け取った電子をさらにタイプ-2銅部位へと渡す「電子伝達部位」として働くことである。すなわち、効率よく銅(II)(d 電子数9)⇄銅(I)(d 電子数10)の酸化状態間を行き来する必要がある。今回、銅を様々な異種金属に置換した場合とでその配位構造にほぼ違いが無いことから、電子伝達時には特に幾何構造に変化は伴わないと考えられる。この幾何構造における剛直性は、本部位が大きな構造変化等でエネルギーを失う事無く最大限に “電子伝達” という機能を発揮する(高効率で電子移動を行う)仕組みの一つと言える。
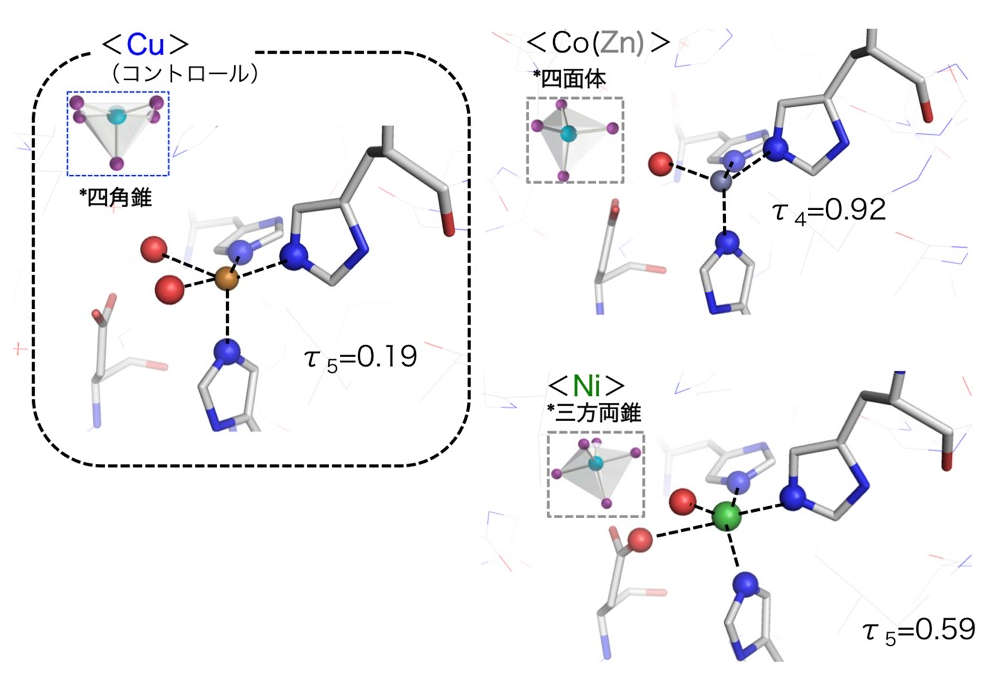
一方、②タイプ-2銅部位は、溶媒水分子の配位も含め、四面体(Co および Zn)、三方両錐(Ni)、そして四角錐(天然 Cu)といった幾何学構造に比較的大きな違いが見られた(表2および図3)。
図3. タイプ-2銅部位の構造。
5配位幾何構造の指標として τ5 = (β-α)/ 60°[10]を用いた。τ4 と同様βとαはその幾何構造の中で最も大きな角度とその次に大きな角度を意味する。Co(および Zn)については4配位構造であったため指標として上述の τ4 を用いた。特に興味深い点は、タンパク質由来の3つのヒスチジン残基および金属原子の位置は3種類の金属でほぼ同一であり、唯一、外部配位子としての水分子などの数、および位置が異なることで幾何構造が変化していた。この幾何構造が変化する主な要因は、各金属イオンの d 軌道電子数(Zn2+:10, Ni2+:8, Cu2+:9)および電子配置の違いによるもので無機化学一般の道理にもあっている。タイプ-2銅部位の役割としては、「1.基質である亜硝酸イオンの配位」、「2.タイプ-1銅から電子の受け取り(還元)」、「3.配位した基質(亜硝酸イオン)の還元」、「4.生成物(一酸化窒素)の放出」の4ステップを効率よく繰り返す触媒部位として働くことであり、今回、観測された幾何構造変化はこの一連のステップを効率よく進ませるために必要なものかもしれない。この点に関しては今後さらなる実験により明らかにされるものと期待される。また、タイプ-2銅部位を異種金属で置換した例も数は少ないがある。その中でもX線結晶構造解析まで進んだものでは銅アミン酸化酵素が挙げられる[11]。本研究と同様に銅アミン酸化酵素においても置換を施すと外部配位子の配置を変えて、明確に幾何学構造が変化している。それ故、本性質は基質の出入り、さらには電子の出入り(酸化還元)を伴う部位においては共通の性質なのかもしれない。
今後の課題:
今回得られた金属結合部位の幾何構造の制約起源に関する基礎的な構造情報(分解能 1.7〜2.35 Å)および実験条件を元に、今後、さらに精度上げた立体構造を決定することが可能と考えられる。またその構造情報を元に量子化学計算を実施し、より電子構造レベルで解析するとともに各種分光学的データとの相関解析を試みる予定である。それらデータは金属酵素の高い反応性をより深い本質的なレベルで理解するための一助となると期待できる。
脚注:
* “緊張” や “張り” などを意味するギリシャ語 “entasis” を語源とした「酵素などの触媒反応部位において、遷移状態に近い高エネルギーを持つ特殊な立体構造を形成した状態」のこと。([1]から抜粋—a state of entasis: the existence is the enzyme of an area with energy, closer to that of a unimolecular transition state than to that of a conventional stable molecule, thereby constituting an energetically poised domain.)
参考文献:
[1] B.L. Valee and R.J.P. Williams, Proc. Natl. Acad. Sci. 59, 498 (1968).
[2] M. Nojiri, et. al., Nature 462, 117 (2009).
[3] M. Nojiri, in "Metalloenzymes in denitrification: Applications and Environmental impacts", I. Moura, J.J.G. Moura, S.R. Pauleta, L.B. Maia eds, RSC Publishing, 2016, Chapter 5, P.91.
[4] L. Yang, et. al., Dalton Trans. 9, 955 (2007).
[5] N. Bonander, et. al., Proteins 27, 385 (1997).
[6] J. M. Moratal, et. al., Eur. J. Biochem., 228, 653 (1995).
[7] C. J. Carrell., et. al., Biochemistry, 43, 9381 (2004).
[8] J. Salgado., et. al., J. Biol. Inorg. Chem., 4, 457 (1999).
[9] C. Dennison and K. sato, Inorg. Chem., 41, 6662 (2002).
[10] A.W. Addison, et. al., J. Chem. Soc. Dalton Trans. 1349 (1984).
[11] S. Kishishita., et. al., J. Am. Chem. Soc., 125, 1041 (2003).
(Received: March 14, 2019; Early edition: May 9, 2019; Accepted: July 16, 2019; Published: August 29, 2019)