Volume7 No.2
SPring-8 Section A: Scientific Research Report
収縮性クロスブリッジにより惹起される心筋トロポニンTの構造変化
Structural Change of Cardiac Troponin Induced by Contracting Crossbridges
a東京慈恵会医科大学, b女子栄養大学, c高輝度光科学研究センター
aThe Jikei University School of Medicine, bKagawa Nutrition University, cJASRI/SPring-8
- Abstract
-
トロポニンT処理法は、除膜筋線維(スキンドファイバー)内の内因性トロポニンTIC複合体を外来性トロポニンTと交換することにより筋線維がカルシウム非依存的に収縮反応を起こすことを可能にする。ラット左心室壁より調製したスキンドファイバーにこの処理を施すと、処理していない場合に比べてATP添加によりトロポニン 38/nm 子午反射が顕著に減少することがわかった。トロポニンT処理後の心筋線維はATPにより収縮状態となっていると考えられることから、心筋トロポニンTは硬直状態から収縮状態への変化に伴い構造変化を起こすことが示唆された。
Keywords: 心筋、トロポニン、収縮
背景と研究目的:
収縮制御タンパクであるトロポニン・トロポミオシンが横紋筋の収縮をどのように制御しているかについては、多くの研究がなされているが未だ明らかになっていない部分も多い。本研究では、心筋収縮力増強を伴う肥大型家族性心筋症の主要な原因の一つとして重要な心筋トロポニンTに焦点を当て、心筋スキンドファイバー内のトロポニンTIC複合体を外来性のトロポニンTに置換したトロポニンT処理[1]標本を用い、ATP添加により収縮を誘発した前後のトロポニン反射の変化を未処理心筋での反応と比較して解析することで収縮クロスブリッジ生成に伴うトロポニンTの構造変化を調べることを目的とした。
実験:
1)心筋スキンドファイバー標本の調製
ラット左室壁より直径 175 ㎛ 以下の筋線維束を切り出し、界面活性剤を含む人工細胞内液(ATP solution; 3.5 mM MgATP, Mg2+1.5 mM イオン強度 0.2, pH 7.0)で3時間処理した。
2)トロポニンT処理法による内在性トロポニンTIC複合体の外来性心筋トロポニンTへの置換
pColdベクターを用いて大腸菌によりリコンビナントトロポニンTを作製し、リコンビナント心筋トロポニンT 1 mg/ml, pH 6.5、KCl 0.25M にて5~8時間処理することで心筋スキンドファイバー内の内在性トロポニンTIC複合体を外来性トロポニンTに置換した。
3)心筋スキンドファイバーからのX線回折像の取得および結果解析
BL45XUにて心筋スキンドファイバー標本に波長 0.1 nm のX線ビームをカメラ距離 1.8 m、露光10秒間/画像の条件で照射し、Rigor solution (Mg2+1.5 mM イオン強度 0.2, pH 7.0)または ATP solution 中で回折像を取得しイメージングプレートに記録し、筋タンパクに由来する反射の強度を解析した。未処理標本に関しては5標本から取得した9~12画像を、トロポニンT処理標本については8標本から取得した10画像を解析に用いた。
4)心筋スキンドファイバー標本の収縮力測定
心筋スキンドファイバー標本を Rigor solution から ATP solution に移した際の収縮張力を張力トランスデューサで測定した。測定した張力は、Ca2+-activating solution(3.5 mM MgATP, 10-4.4 M Ca2+ ,イオン強度 0.2, pH 7.0)中での値に対する相対値として表した。
結果:
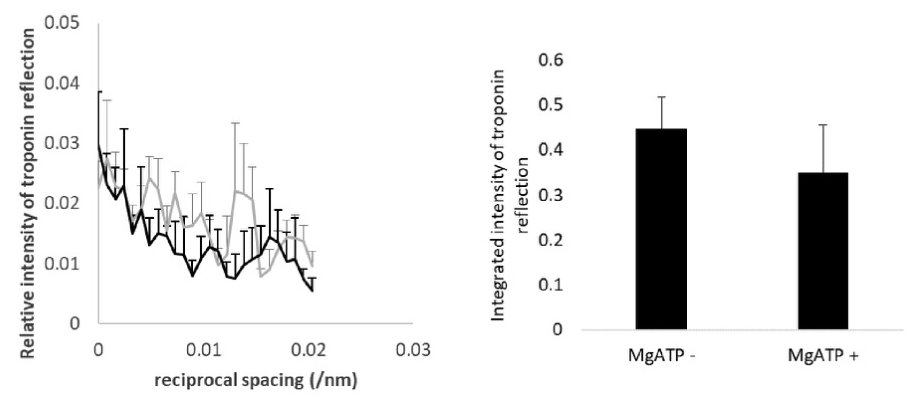
トロポニンT処理を施さない未処理心筋では MgATP を含まない Rigor solution から MgATP を含む ATP solution に移しても、38/nm トロポニン反射の赤道方向強度プロファイルに明らかな違いはみられなかった。この反射の積分強度を比較しても有意な差は認められなかった(図1)。
図1.未処理心筋のMgATP添加前(MgATP -;灰色)と後(MgATP +;黒)の 38/nm トロポニン子午反射の赤道方向強度プロファイル(左)、および積分強度(右)。(5標本から取得した 9; MgATP - または 12; MgATP + 画像からの平均値と標準誤差。)トロポニン反射強度は、MgATP 添加前の 5.9/nm アクチン層線の積分強度に対する相対値として示した。
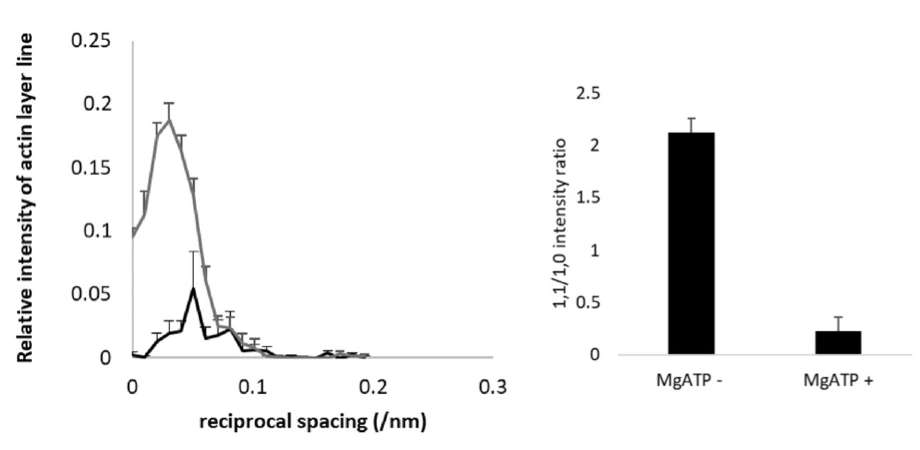
これらの標本のアクチン層線(5.9/nm)強度プロファイルと赤道反射強度比は MgATP 添加に伴い弛緩状態の特徴を示す型に変化することが確認された。未処理心筋では硬直から弛緩への状態遷移に伴ってトロポニン構造に大きな変化が見られないことが示された(図2)。
図2.未処理心筋のMgATP添加前(MgATP - ;灰色)と後(MgATP +;黒)でのアクチン層線(5.9/nm)の赤道方向強度プロファイル(左)と赤道反射強度比(右)(5標本から取得した 9;MgATP -または 12;MgATP + 画像からの平均と標準誤差)。アクチン層線の強度は、MgATP添加前の 5.9/nm アクチン層線の積分強度に対する相対値として示した。
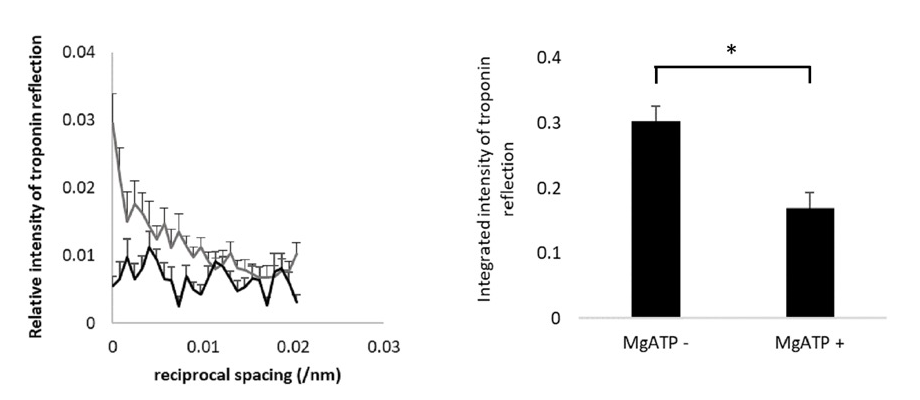
一方トロポニンT処理により心筋スキンドファイバー内の内在性トロポニンTIC複合体を外来性トロポニンTに置換した標本では、MgATP 添加によりトロポニン反射強度が有意に減少した(図3)。
図3.トロポニンT処理心筋のMgATP添加前(MgATP -;灰色)と後(MgATP +;黒)での 38/nm トロポニン子午反射の赤道方向強度プロファイル(左)、および積分強度(右)(8標本から取得した MgATP - および MgATP + についての各10画像からの平均と標準誤差)。トロポニン反射強度は、MgATP添加前の 5.9/nm アクチン層線の積分強度に対する相対値として示した。* は t 検定による p<0.02 の有意差を示す。
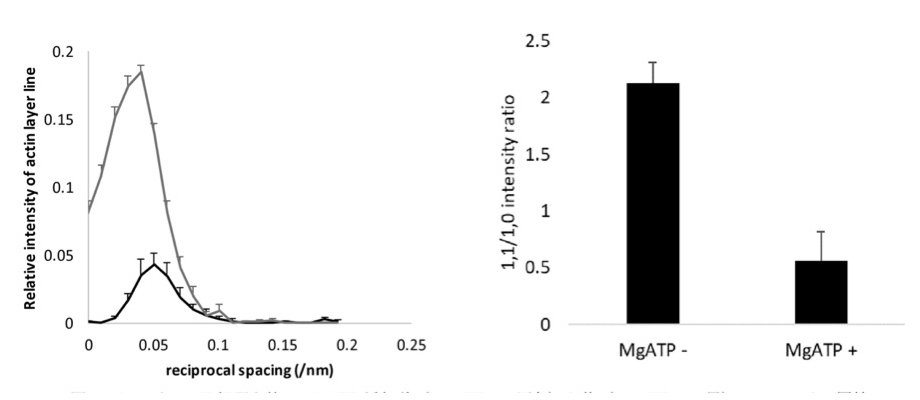
トロポニンT処理標本でのアクチン層線(5.9/nm)強度プロファイルは、MgATP 添加により硬直クロスブリッジが失われたことを示した。1,1/1,0 赤道反射強度比は、MgATP 添加により減少したが、未処理心筋の場合と比較すると大きな値を示し、ミオシン頭部がアクチンと相互作用している可能性を示唆した(図4)。
図4.トロポニンT処理心筋のMgATP添加前(MgATP -;灰色)と後(MgATP +;黒)でのアクチン層線(5.9/nm)の赤道方向強度プロファイル(左)と赤道反射強度比(右)。(8標本から取得した MgATP - および MgATP + についての各10画像からの平均と標準偏差。)アクチン層線の強度は、MgATP添加前の 5.9/nm アクチン層線の積分強度に対する相対値として示した。
収縮張力測定を行ったところ、未処理心筋では MgATP 添加により収縮張力の発生はほぼ認められず、筋が弛緩状態となっていることが確認されたのに対し、トロポニンT処理心筋では MgATP 添加により最大収縮張力の8割以上の張力が発揮された(図5)。トロポニンT処理後の無カルシウム条件での収縮張力はトロポニンT処理による内在性トロポニンTIC複合体のトロポニンTへの交換率を反映して増加することが示唆されている[1][2] (Yamaguchi, unpublished data) ことから、この結果より、トロポニンT処理標本では8割方の内在性トロポニンTIC複合体が外来性トロポニンTに交換されていると考えられた。すなわち、未処理標本では MgATP添 加により硬直から弛緩への変化が起きたのに対して、トロポニンT処理標本では MgATP 添加により相当量の収縮クロスブリッジの生成が起きていると考えられた。これより、硬直から収縮へのクロスブリッジの状態遷移がトロポニンTを大きく構造変化させる作用をもつことが示唆された。
図5.トロポニンT処理経過中の張力記録の例(左)。各横棒で示した時間に Ca2+ -activating solution, MgATP- (rigor) solution, MgATP+ (ATP) solution, BDM solution (ATP solutionに収縮抑制剤 butanedione monoxime を 20 mM 添加したもの)に移した。トロポニンT処理および未処理心筋のMgATP添加による収縮張力の最大カルシウム張力に対する相対値(右)。8例(トロポニンT処理)または5例(未処理)からの平均と標準誤差。
考察:
骨格筋では収縮にともなうクロスブリッジの生成がトロポニンの構造変化を引き起こし、トロポニン 38/nm 反射強度を減弱させることが報告されている[3][4][5]。本結果はこれらの報告と同様の構造変化が心筋でも起きたことを示唆する。また、本実験ではトロポニンIおよびCの大半が除去されているとから、トロポニンTのみでもトロポニン反射が減弱するような構造変化が起きていることが示唆された。
Knowles ら[6]は蛍光偏光測定法により骨格筋トロポニン中心部(core complex)構造の細いフィラメント軸との傾きの角度が、弛緩状態と硬直状態ではあまり変わらないのに対して収縮状態では小さくなることを報告している。本実験結果からはトロポニン軸の傾きを議論することはできないが、硬直クロスブリッジから収縮クロスブリッジへの状態遷移がトロポニン構造に対して、顕著な効果を及ぼすと示唆されたことは彼らの結果と定性的に合致すると考えられる。
今後の課題:
本課題では、家族性心筋症誘発変異トロポニンTが収縮力増強を起こす機序を構造的に解明することを当初の目的に含んでいたが、実験時間の範囲内ではその機序解明のための基盤となる結果を得ることで終了した。今後はアミノ酸変異を導入したトロポニンTを心筋スキンドファイバーに置換した標本での構造的差異を検出することにより、家族性心筋症発症分子機序に対する構造的基盤を確立することを目指したい。
謝辞:
本課題の一部は、文部科学省科学研究費基盤研究C(2011年~2013年)の補助を受けて行った。
参考文献:
[1] M. Hatakenaka, I. Ohtsuki, Eur. J. Biochem. 205, 985-993 (1992).
[2] S. Morimoto et al., PNAS, 99, 913-918, (2002).
[3] N. Yagi, Biophys. J., 84, 1093-1102 (2003).
[4] T. Matsuo, H. Iwamoto, N. Yagi, Biophys. J. 99, 193-200 (2010).
[5] T. Tamura et al., Biophys J., 96, 1045-1055, (2009).
[6] A. C. Knowles, M. Irving, Y-B. Sun, J. Mol. Biol. 421, 125-137, (2012).
(Received: December 29, 2018; Early edition: April 10, 2019; Accepted: July 16, 2019; Published: August 29, 2019)