Volume7 No.1
SPring-8 Section A: Scientific Research Report
一酸化炭素が結合した一酸化窒素還元酵素の核共鳴非弾性散乱分光測定
Measurement of Carbon Monoxide-bound Form of Membrane-integrated Nitric Oxide Reductase by Nuclear Resonance Vibrational Spectroscopy
a理化学研究所 SPring-8、b(公財)高輝度光科学研究センター
aRIKEN, SPring-8 Center, bJASRI
- Abstract
-
一酸化窒素(NO)は、反応性に富んだラジカル分子であり高い細胞毒性を示す。細菌が持つ膜結合型一酸化窒素還元酵素(NOR)は、ヘム鉄と非ヘム鉄からなる複核活性中心をにおいて、細胞毒である NO を電子とプロトンを利用して、亜酸化窒素(N2O)へと還元・無毒化する。本研究では、NOR による NO 還元反応の分子機構解明のために、鉄を含む活性部位の構造解析に有効な核共鳴非弾性散乱(NRVS)に着目した。活性部位に基質の類似体である一酸化炭素(CO)を結合させた試料の測定を行った。共鳴ラマン分光測定の結果と比較し、得られた NRVS スペクトルについて考察した。
Keywords: 核共鳴非弾性散乱、金属タンパク質、ヘム鉄、非ヘム鉄、共鳴ラマン分光
背景と研究目的:
我々の体内に病原菌が侵入すると免疫系が機能し、化学兵器として一酸化窒素(NO)が合成され、病原菌を攻撃する。一方で、病原菌は、一酸化窒素還元酵素を使って NO を還元・無毒化し、宿主内での生育をはかる。日和見感染菌として院内感染の主たる原因となる緑膿菌(Pseudomonas aeruginosa)は膜結合型の一酸化窒素還元酵素(NOR)をもっており、ヒトの免疫系が産生する NO を分解することができる[1]。
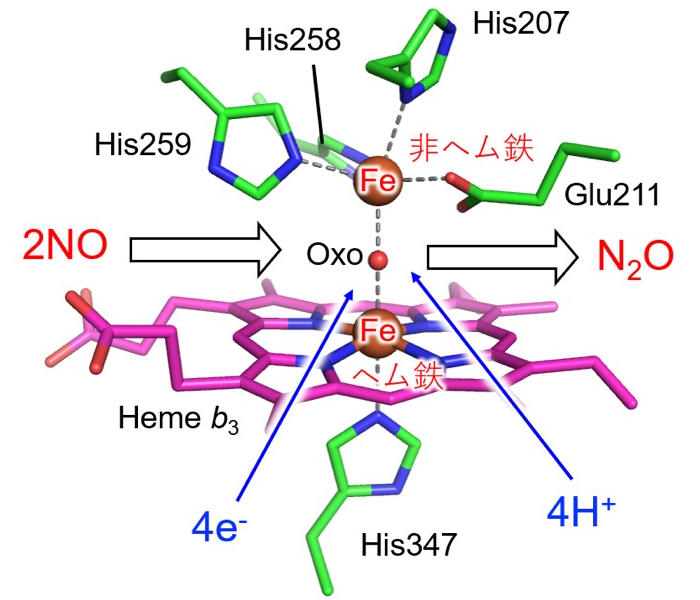
NOR は、ヘム鉄と非ヘム鉄から構成される複核活性中心をもち、2当量の電子とプロトンを利用することで2分子の NO から亜酸化窒素(N2O)と水分子を生成する(2NO + 2e- + 2H+ → N2O + H2O)(図1)。この反応には、NO の鉄への配位、鉄から NO への電子供与、NO へのプロトン供与、N-N 結合の形成および N-O 結合の開裂といった化学の基礎ともいえるプロセスが詰め込まれており、それらが巧妙に共役することで NO の還元が行われる。そのため、多くの研究者が NO 還元反応の分子機構に興味をもっている[2]。我々は、世界ではじめて NOR の立体構造を明らかにし、その構造を基盤に反応機構の考察を行ってきた [3,4]。近年は、分光法による活性部位の構造解析にも取り組んでいるが、NO 還元反応の分子機構は未解明である。
図1. NOR の活性部位の構造[3,4]。ヘム鉄と非ヘム鉄からなる活性部位で NO 還元反応が起こる。
我々は、NOR の触媒反応機構に関する研究を進めるために、活性部位の鉄原子の電子状態や配位構造を検討することが可能な核共鳴非弾性散乱測定(Nuclear Resonance Vibrational Spectroscopy: NRVS)[5]に注目し、NRVS 測定のための NOR の調製法を検討してきた[6,7]。NRVS は、他の分光法では観測が難しい非ヘム鉄に関する構造情報が得られる点や、鉄の価数やスピン状態によらず測定が可能である点で非常に魅力的である。これまでに、NRVS 測定に必要な鉄の同位体(57Fe)を活性部位にもつNORを高濃度(1 mM 以上)で調製する手法を確立した。また、基質結合型のモデルとして基質アナログであるシアン化物イオン(CN-)結合型の NRVS 測定にも挑戦してきたが、試料調製の困難さもあり、鉄とシアン化物イオンの結合に由来するシグナルを観測することができなかった[7]。本研究では、より安定に試料調製が行える CO を基質アナログとして用い、鉄と CO の振動モードの同定を目指した。これまでに、CO を鉄活性部位に結合させた多くの研究が行われてきており、それらデータの蓄積のおかげで、鉄と CO の間の振動に関するデータから鉄の電子状態や活性部位周辺との相互作用など活性部位環境の情報が得られるという利点がある[8]。基質類似体である CO が結合した際の活性部位の構造情報は、NOR の酵素反応中に過渡的にしか存在しない基質 NO 結合型の構造を理解する助けになる[9]。
実験:
57Fe を含む合成培地で生育させた緑膿菌から NOR を精製することで、NOR の活性部位に存在する鉄が 57Fe に置換されたものを調製した。試料の精製は、既報に従った[3,4]。調製した試料の NO 還元活性を調べ、活性のある酵素が精製できていることを確認した。精製標品は、50 mM HEPES buffer pH 7.0、0.05% (w/v) ドデシルマルトシド(DDM)に溶解させた。NRVS スペクトルの測定には、タンパク質としては高濃度(1 mM 以上)の試料を必要とするので、精製試料を遠心濃縮により限界まで濃縮したものを準備した。
還元 CO 結合型試料の調製は、還元シアン結合型の調製法[7]に基づいて行った。酸化型の試料をゴム栓のできるバイアル瓶に入れた後、真空ポンプにより CO 雰囲気にした。ジチオナイトの粉を別のバイアル瓶に入れて、こちらも真空ポンプにより CO 雰囲気にした。ガスタイトシリンジを用いて CO 雰囲気にした NOR 試料をとり、ジチオナイトの粉が含まれたバイアル瓶に移した。試料が還元されたことを示す茶色から赤色への変化を確認し、還元 CO 型の試料とした。CO 由来の振動モードを帰属するために CO の同位体(13CO)を用いて、同様に、還元 CO- 結合型の試料を調製した。
それぞれの試料は、ガスタイトシリンジにより NRVS 測定用のセルに導入し、素早く液体窒素で凍結した。凍結した試料は、BL09XUにて、クライオスタット中のセルホルダーに設置した。NRVS 測定は、BL09XUにおいてタンパク質の NRVS 測定を行う際の標準的な装置配置で行った。Si975-Si975 の高分解能モノクロメータによって 0.8 meV に分光したX線をクライオスタット中において液体 H e温度に保った凍結試料に照射し、APD検出器で核の準位を経た時間遅れの成分だけをカウントした。入射X線のエネルギーを -20 ~ 80 meV の範囲で走査し、NRVS スペクトルを測定した。100回程度の積算を行い、NRVS スペクトルを得た。本測定条件では、一回のエネルギー走査に約45分の時間がかかり、一つの NRVS スペクトルを得るには、2 ~ 3日程度の測定時間を要した。
結果および考察:
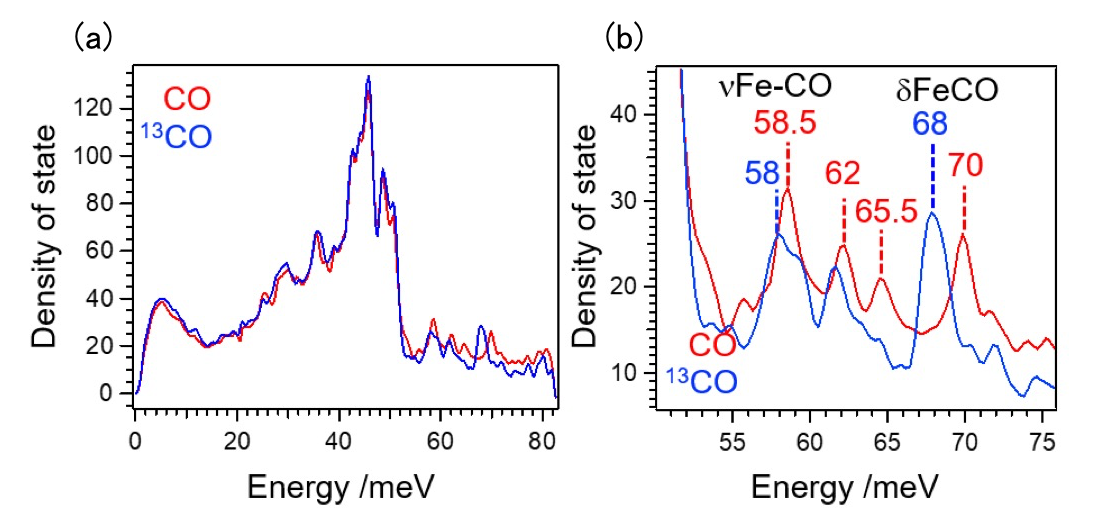
図2a に CO 結合型 NOR の NRVS スペクトルを示す。鉄とヒスチジンやポルフィリン環ピロール由来の窒素原子間の振動モードに由来すると推定される 20 ~ 50 meV のエネルギー領域のシグナルに加えて、55 ~ 75 meV のエネルギー領域に複数のシグナルが検出された。過去の CO 結合型のヘムタンパク質を用いた研究から、鉄-CO の伸縮振動(νFe-CO)および鉄-CO の変角振動(δFeCO)は、それぞれ、55 ~ 70 meV および ~70 meV に観測されることが知られており[8]、図2b に みられるシグナルに鉄-CO に由来する振動モードが含まれるものと考えられる。
図2. 還元 CO- 結合型 NOR の NRVS スペクトル。同位体である 13CO を用いた場合のスペクトルもあわせて示す。図2a は、測定を行ったエネルギー領域全体を示しており、図2b は、鉄と CO の振動モードが観測されるエネルギー領域の拡大図を示している。NRVS 測定は、BL09XUで行った。
鉄-CO に関連する振動モードの帰属を行うために、同位体 CO(13CO)を用いた場合の NRVS スペクトルと比較した(図2)。70 meV にみられたシグナルは、同位体 CO を用いることで、68 meV と低エネルギー側にシフトして観測された。観測されたエネルギー領域および同位体によるシフト幅から、70 meV のシグナルは、鉄-CO の変角振動であると帰属した。また、58.5 meV に検出されたシグナルが、13CO を用いた場合に 58 meV にシフトして観測された。13CO を用いた場合、鉄-CO 伸縮振動は、理論値で約 0.5 meV のシフトを示すと見積もられるので、58.5 meV のシグナルは、鉄-CO 伸縮振動に由来すると解釈した。その他、62 meV および 65.5 meV にみられるシグナルも 13CO を用いることで、シフトを示す可能性が示唆された。しかし、現時点では、これらのシグナルが 13CO で得られた NRVS スペクトルのどのシグナルに対応するのか明確ではないため、その帰属には至らなかった。これらの帰属を行うためには、C18O や 13C18O などの他の同位体を用い、より系統的な解析を行う必要がある。
NOR の活性部位には、ヘム鉄と非ヘム鉄が存在し、CO は、どちらの鉄とも結合する可能性がある。本研究でみられたシグナルが、どちらの鉄に結合した CO を観測しているのか理解するために、共鳴ラマン分光測定により決定されたヘム鉄-CO の伸縮振動と変角振動の値と比較した。共鳴ラマン分光測定では、ヘムの共鳴効果を利用することで、ヘム鉄に結合した CO に由来するシグナルのみを選択的に検出することができ、過去の結果から、NOR のヘム鉄と CO の伸縮振動および変角振動は、60 meV および 72.5 meV に観測されることが明らかとなっている[10]。理論上、NRVS スペクトルにおいてもヘム鉄と CO 間の振動モードが観測されるはずであるが、本研究でみられたシグナルは、いずれも共鳴ラマン測定で検出されたヘム鉄と CO 間の振動モードと一致しなかった。そのために、NRVS で得られた結果のさらなる解釈を進めることができなかった。二つの振動分光測定において結果が一致しなかった理由として、測定温度の違い、すなわち共鳴ラマン分光測定は室温であったのに対し、NRVS 測定はヘリウム温度あった点が考えられる。今後、凍結試料の共鳴ラマン分光測定を行うことで、NRVS スペクトルの解釈が進むことを期待したい。
今後の課題:
本研究では、CO 結合型の NOR の NRVS 測定から NOR の活性部位の構造解析に挑戦した。これまでの NRVS 測定の経験から、試料の調製法が確立でき、活性部位の鉄と CO 間の振動モードに由来するシグナルの検出に成功した。他の振動分光法との比較から得られたシグナルの帰属をこころみたが、それぞれの測定温度の違いなどもあり、得られた鉄と CO 間の振動数から活性部位の構造についての議論をするには至らなかった。本研究では、膜タンパク質であり二つの鉄を含む複雑な活性部位を持つ NOR を研究対象としたが、より単純な構造を持つ金属タンパク質でのデータが蓄積することで、スペクトルの解釈への道筋が整い、NRVS スペクトルの有効利用が進むものと考えられる。
参考文献:
[1] K. Kakishima et al., Biochem. Biophys. Res. Commun., 355, 587 (2007).
[2] P. Moënne-Loccoz, Nat. Prod. Rep., 24, 610 (2007).
[3] T. Hino et al., Science, 330, 1666 (2010).
[4] N. Sato et al., Proteins, 82, 1258 (2014).
[5] R. W. Scheidt, J. Inorg. Biochem., 99, 60 (2005).
[6] T. Tosha et al., SPring-8/SACLA利用研究成果集, 6, 153 (2018).
[7] T. Tosha and Y. Yoda, SPring-8/SACLA利用研究成果集, 6, 174 (2018).
[8] X.-Y. Li and T. G. Spiro, J. Am. Chem. Soc., 110, 6024 (1988).
[9] S. Lu et al., J. Am. Chem. Soc., 116, 15332 (2004).
[10] T. Terasaka et al., Biochim. Biophys. Acta., 1837, 1019 (2014).
ⒸJASRI
(Received: September 28, 2018; Early edition: December 26, 2018; Accepted: December 17, 2018; Published: January 25, 2019)