Volume7 No.1
SPring-8 Section A: Scientific Research Report
人工FADを用いたD-アミノ酸酸化酵素の酵素・基質複合体の構造解析
Structural Investigation on the ES Complex of D-amino Acid Oxidase By using Artificial FAD
a大阪市立大学, b熊本大学
aOsaka City University, bKumamoto University
- Abstract
-
補酵素FADの8位のメチル基を NHCH3 に置換したHM-FADをD-アミノ酸酸化酵素(DAO)に再構成させた酵素は、酸化力が低下し反応が進行しないため、DAOの基質D-アミノ酸と安定な複合体を形成することができる。そこでHM-FADを再構成したDAOと基質D-アミノ酸との複合体結晶構造を得ようと試みたが、基質が活性部位に固定された構造を得ることが出来なかった。
Keywords: D-アミノ酸酸化酵素、ES複合体
背景と研究目的:
D-アミノ酸酸化酵素(DAO)は、FADを補酵素とするフラビン酵素であり、D-アミノ酸を酸化してα-イミノ酸にする反応を触媒する。DAOは生体内では、脳内に比較的高濃度に存在し、神経伝達物質として作用するD-セリンの代謝を介し、神経伝達の調節に関与することが指摘されている。我々はこれまでに、DAOとBenzoate複合体結晶を作成した後、その結晶にD-アミノ酸アナログとしての o-amino-benzoateをソーキングして得られた結果 [1]や、D-プロリンをソーキングして反応させることでイミノ酸プロリンを結合した構造[2]を得ることにより、DAOの反応機構を提唱した。今回、FADの8位をN-メチル基で置換し、酸化力が低下した人工FADを用いることで、基質が結合しても反応が進行しない酵素・基質(ES)複合体の立体構造を得ることを試みた。また、ソーキングするD-アミノ酸としてはD-セリンの他、 溶液中で混合すると吸光度変化がみられるため、蛋白質に結合すると予測される(未発表)D-ロイシンとD-バリンを用いることとした。
実験:
8位のメチル基をN-メチル基で置換したリボフラビンは前大阪市大の笠井氏より提供された[3]。置換リボフラビンをFAD合成酵素によりFAD型にし、C18のHPLCカラムを用いて精製した。ブタ腎臓由来のD-アミノ酸酸化酵素(DAO)は、大腸菌で大量発現したのち既報の通り精製を行い、2 M KBr を含む緩衝液(100 mM Na-ピロリン酸, pH 8.3)での透析によりFADをはずした後、KBrを含まない緩衝液で透析してから、人工FADを加えることで再構成した。再構成したDAOを用いて、野生型酵素と同様にBenzoateと共結晶化すること[1]により、X線構造解析に適した結晶が得られた。Benzoateを含まない沈殿剤溶液(200 mM Na-Acetate, 100 mM Na-citrate, 30 %(w/v) PEG4000)で結晶を洗った後、10 mM のD-ロイシン、D-セリン、D-バリンをそれぞれ沈殿剤溶液に加えたものに12時間漬けることにより、基質アミノ酸のソーキングを試みた。ソーキング後の結晶は,そのままループですくい -180℃ の条件下でBL38B1にてデータ収集を行った。位相決定は、既に構造が分かっている野生型DAO(PDB ID; 1VE9)のBenzoate複合体構造をモデル構造とした分子置換法により決定し、全てのデータについて構造解析を行った。また、構造解析の結果、Benzoateが活性中心に残っていた場合には、さらに濃度をあげ、ソーキング時間を長くするなどの検討をおこない、再測定をした。それぞれの基質について複数のデータを収集したが、最も分解能が良かったものについて表1に纏めた。
| soaking | D-ロイシン | D-セリン | D-バリン |
| soaking 濃度と時間 | 10 mM, 12h | 100 mM, 2days | 10 mM, 2days |
| 格子定数 (a,b,c) | 71.93, 90.36, 108.31 | 70.41, 91.96, 109.44 | 70.72, 91.70, 108.79 |
| 分解能 (Å) | 50.0-2.10 (2.18-2.10) | 50.0-2.10 (2.18-2.10) | 50.0-2.0 (2.07-2.0) |
| redundancy | 5.4 (5.5) | 5.4 (5.5) | 5.7 (5.6) |
| completeness (%) | 99.7 (100.0) | 99.8 (100.0) | 96.0 (98.3) |
| I/σ (I) | 46.0 (5.88) | 43.79 (9.78) | 42.23 (6.4) |
| Rmerge (%) | 6.3 (27.7) | 12.2 (24.2) | 7.3 (24.1) |
| Rfactor (%) | 21.1 | 23.1 | 23.5 |
| Rfree (%) | 25.9 | 29.1 | 28.5 |
結果および考察:
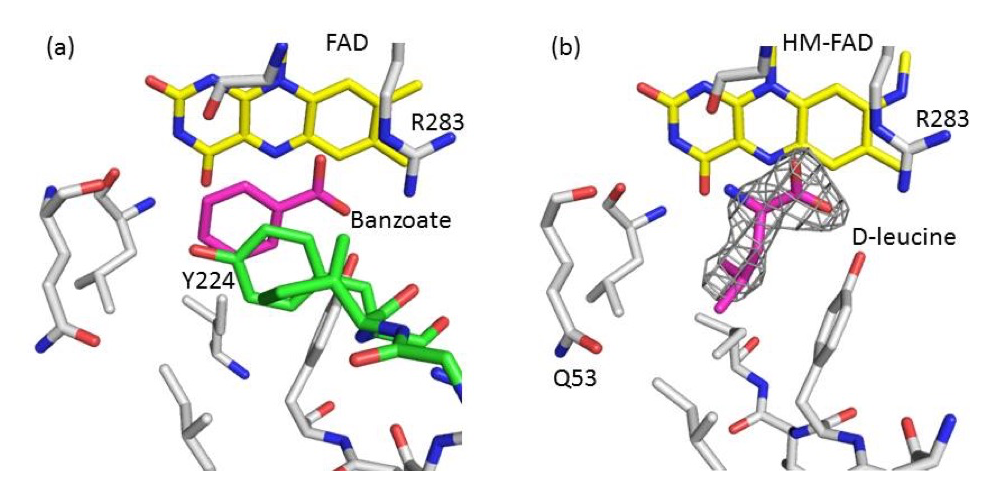
D-ロイシンをソーキングした複合体については、活性部位にはBenzoateでないと思われる電子密度が見られたため、D-ロイシンを合わせてモデルを構築し精密化を行った(図1)しかし、精密化の結果、D-ロイシンの平均温度因子は 70 Å2 となり、この値は、結晶全体の平均温度因子 45 Å2 や、人工FADの平均温度因子 40 Å2 対して高く、活性部位に固定されていないことが明らかとなった。DAOとBenzoate複合体構造(PDB ID; 1VE9)の場合には、Benzoateはループ構造が活性部位を閉じるように存在しているのに対し、今回得られた構造ではこのループ部分にあたる電子密度が見えていない。すなわち、D-ロイシンは活性部位に結合してもループが閉じず、揺らいでいるということが分かった。
図1.野生型Benzoate複合体(a)と人工FAD再構成型D-ロイシン複合体(b)の活性部位Benzoate複合体ではY224を含むループ(緑)が活性部位を閉じるように存在している。(b)にはD-ロイシンに相当する 2Fo-Fc マップ(2σ)を描いている。
D-バリンとD-セリンについては、ソーキングする濃度や時間を変化させ、複数のデータ収集を行ったが、アミノ酸の結合サイトにはBenzoateの電子密度が見えるか、あるいはまったく電子密度が無い構造しか得られなかった。両者とも野生型酵素の基質であるので、酸化力が下がっていても大過剰にD-アミノ酸を加えれば結合するのではないかと想定し実験を行ったが、結合したのち代謝されてしまったか、結合するために必要な構造変化が結晶中では出来なかったと考えられる。
今後の課題:
今回利用した結晶化条件で析出した結晶では、基質濃度やソーキング時間を調整することではES複合体を得ることが難しいことが明らかとなった。人工FADで再構成したDAOを用いて、ソーキング法によりES複合体構造を得ようとするならば、Benzoateを含まない、新たな結晶化条件を探索する必要がある。
参考文献:
[1] H. Mizutani et al., J. Biochem., 122, 825 (1997).
[2] H. Mizutani et al., J. Biochem., 128, 73 (2000).
[3] S. Kasai et al., J. Nutr. Sci. Vitaminol., 24, 201 (1978).
ⒸJASRI
(Received: September 11, 2018; Early edition: November 28, 2018; Accepted: December 17, 2018; Published: January 25, 2019)