Volume7 No.1
SPring-8 Section A: Scientific Research Report
うま味受容体細胞外リガンド結合ドメインのX線結晶構造解析
Crystallographic Analysis of the Ligand-binding Domains of Umami Taste Receptor
岡山大学大学院医歯薬学総合研究科
Graduate School of Medicine, Dentistry and Pharmaceutical Sciences, Okayama University
- Abstract
-
T1r1/T1r3ヘテロ二量体は、味覚受容において、アミノ酸などを感知するうま味受容体として機能する。T1r1/T1r3受容体の主要な味物質結合部位であるリガンド結合ドメインについて、組換え発現・精製・結晶化を行い、得られた結晶のX線回折実験を行った。その結果、結晶から確認された回折は、異方性が高く、構造決定に十分な分解能の回折強度データを得ることができなかった。
Keywords: 味覚受容体、クラスC型GPCR
背景と研究目的:
食物中に含まれる味物質の感知は口腔内に存在する味覚受容体が担っている。脊椎動物においては、味覚は甘味・うま味・苦味・塩味・酸味の基本五味と呼ばれる味質それぞれ固有に存在する味覚受容体を介して感知されている[1]。このうち、甘味物質とうま味物質を感知する受容体は、クラスC型Gタンパク質共役型受容体(GPCR)ファミリーに属するTaste receptor type 1 (T1r)ファミリーである。クラスC型GPCRは、①ヘテロ二量体として機能する、②細胞外に500アミノ酸残基程度のリガンド結合ドメイン(LBD)を持ち、LBDで主要なアゴニストを認識する、との構造的特徴を持つ受容体群である[2]。T1r受容体でも、これらの構造的特徴を利用して味物質認識を行っており、ヒトではT1r1とT1r3のヘテロ二量体のLBDがグルタミン酸などのうま味物質の認識、T1r2とT1r3のヘテロ二量体のLBDが糖などの甘味物質の認識を担っている[3-5]。
これまで味覚受容体については立体構造が明らかになっておらず、味物質の認識メカニズムは不明であった。最近、我々のグループでは、味覚受容体としては初めての立体構造となるメダカ由来T1r2a/T1r3LBDヘテロ二量体の結晶構造を、SPring-8を用いて解明した[6]。一方、T1r受容体として機能するもう1つの受容体であるT1r1/T1r3ヘテロ二量体については、いまだ構造情報が明らかとなっていない。そこで、T1r受容体による味物質認識の共通性と多様性を解明することを目的に、T1r2/T1r3ヘテロ二量体とは異なる味覚モダリティーの感知を担うT1r1/T1r3LBDヘテロ二量体の結晶構造解析に取り組んだ。
実験:
各種脊椎動物由来のT1r1LBDおよびT1r3LBD遺伝子のうち、蛍光検出ゲルろ過クロマトグラフィー解析[7]により良好な発現が見られたものについて、メダカ由来T1r2a/T1r3LBDのタンパク質発現系を構築したときと同じ方法[8]を用いて、ショウジョウバエS2細胞の安定発現クローン細胞を確立した。T1r1LBDおよびT1r3LBD遺伝子は、3’ 側にFactor Xa認識配列、FLAGタグ配列、Hisタグ配列を順に融合した形でS2細胞に導入した。
T1r1/T1r3LBDヘテロ二量体タンパク質の発現と精製は、基本的にメダカ由来T1r2a/T1r3LBDと同様の方法で実施した[5, 9]。具体的には、発現S2細胞を 5 µM kifunensine含有ExpressFive SFM (Gibco)培地を用いて 27 ˚C で5日間培養した。得られた培養培地から、Anti-FLAG M2 affinity gel (SIGMA)を用いて発現T1r1/T1r3LBDタンパク質を回収した。得られたタンパク質について、Factor Xa (Millipore)処理を行って精製タグを切除し、Endo H処理を行って糖鎖を切断した。酵素処理後のタンパク質をSuperdex200 10/300 GL (GE Healthcare)を用いてゲルろ過クロマトグラフィーにより精製した。
得られた精製タンパク質は、ポリエチレングリコールを沈殿剤としてハンギングドロップ蒸気拡散法により20 ˚Cで結晶化した。得られた結晶は液体窒素にて凍結した。X線回折実験は、SPring-8のBL41XUにて波長 0.979 Å のX線と検出器PILATUS 6M (DECTRIS)を用いて、あるいはBL26B1にて波長 0.97 Å のX線と検出器Saturn A200 (Rigaku)を用いて行った。結晶の格子定数はHKL2000 [10]を用いて決定した。
結果および考察:
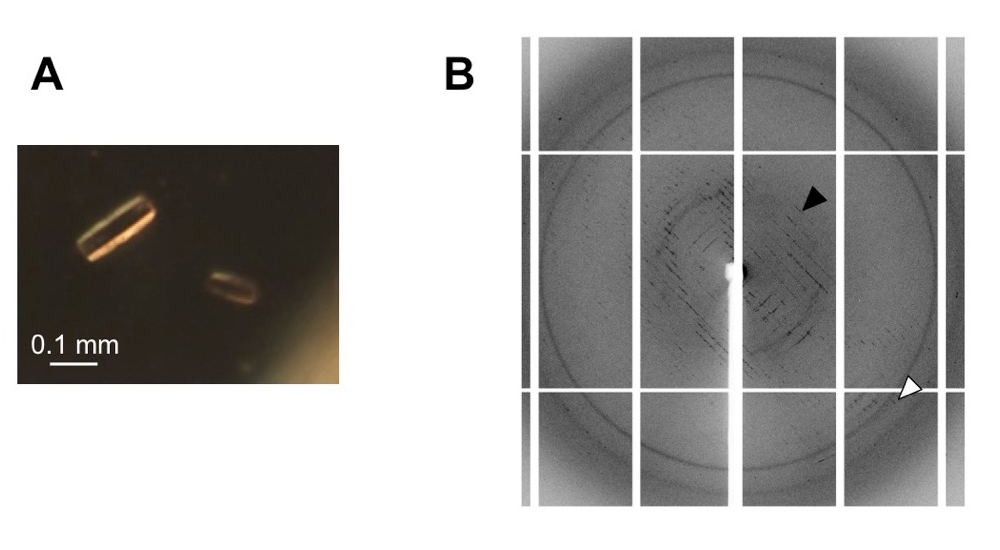
精製T1r1/T1r3LBDヘテロ二量体試料の結晶化条件スクリーニングの結果、ポリエチレングリコールを沈殿剤とした3条件から、最大で大きさ 0.1 mm 程度の直方体結晶を得ることができた(図1A)。BL26B1にて結晶にX線を照射したところ、タンパク質結晶由来と推測される回折点が観察された(図1B)。そこで、結晶化条件の最適化を試み、種々の結晶化・凍結条件で作製した合計46個の結晶の回折能確認を行った。しかしながら、結晶からの回折には異方性が見られ、最も良好な回折を示したものでも、一方向には約 3.9 Å 分解能まで回折点が確認できたものの、他方向には約 7.6 Å 分解能までしか回折点が確認できなかった。また、BL26B1にて180秒までの露光時間の延長や、BL41XUを用いた回折実験を行ったが、それ以上の分解能の向上は見られなかった。したがって、残念ながら構造決定に十分な分解能の回折強度データを得ることはできなかった。
得られた回折像より、結晶の格子定数を決定した。結晶系は直方晶系、ラウエ群は mmm、格子定数は a = 71.3 Å、b = 122.3 Å、c = 597.3 Å であった。得られた格子定数とT1r1/T1r3LBDの分子量(アミノ酸配列より計算したもので 107.0 KDa)を勘案すると、非対称単位中に含まれるT1r1/T1r3LBD ヘテロ二量体が4分子、5分子、6分子の場合、Matthews Coefficientがそれぞれ 3.04、2.43、2.03 Å3/Da となるため、非対称単位中の分子数として可能性が高いのは 4~6 分子であると考えられた。
図1.T1r1/T1r3LBDヘテロ二量体結晶(A)およびそのX線回折像(B)。X線回折像は、BL26B1を用いて、実験項記載の条件にて、露光時間180秒で撮影したものである。白矢印は 3.9 Å 分解能、黒矢印は 7.6 Å 分解能の回折点を示す。
今後の課題:
組換え発現・精製したT1r1/T1r3LBD ヘテロ二量体試料より結晶を得ることができたものの、X線回折能が低く、構造決定には至らなかった。その要因の1つとしては、得られている精製標品の純度や均一性が十分でない可能性が考えられる。そこで、発現・精製条件の過程から条件を改善していく必要がある。また、現在得られている結晶も、c 軸の格子軸長が約 600 Å と極めて長く、また回折にも異方性が見られるなど、構造解析可能な程度までの劇的な分解能向上をのぞめるかどうかはわからない。そこで、現在の結晶化条件の最適化とともに、さらに高分解能が得られる新たな結晶を得ることを目指して、より純度・均一性を向上した精製試料を用いてあらためて結晶化条件探索をやり直し、異なる結晶系で結晶化する条件を再探索する必要性もあると考えられる。
今回結晶化したT1r1/T1r3LBDと、すでに構造決定されているメダカT1r2a/T1r3LBDの相同性は、分子量レベルでの差は小さく(後者についてアミノ酸配列より計算したもので 104.6 KDa)、T1r3同士のアミノ酸配列の同一性が 59.7%、T1r1とT1r2a間では 33.3% である。このことから、上述の条件検討の結果、良好な分解能で回折するT1r1/T1r3LBD結晶が得られれば、構造決定自体は、メダカT1r2a/T1r3LBD構造を用いた分子置換法により、迅速に解析可能と推測される。
参考文献:
[1] D. A. Yarmolinsky, et al. Cell 139, 234 (2009).
[2] J. P. Pin, et al. Pharmacol. Ther. 98, 325 (2003).
[3] G. Nelson, et al. Cell 106, 381 (2001).
[4] G. Nelson, et al. Nature 416, 199 (2002).
[5] X. Li, et al. Proc. Natl. Acad. Sci. USA 99, 4692 (2002).
[6] N. Nuemket, N. Yasui, et al. Nat. Commun. 8, 15530 (2017).
[7] Y. Ashikawa, et al. Prot. Sci. 20, 1720 (2011).
[8] A. Yamashita, et al. Prot. Sci. 26, 2291 (2017).
[9] E. Nango, et al. Prot. Sci. 26, 2291 (2017).
[10] Z. Otwinowski, W. E. Minor, Methods Enzymol. 276, 307 (1997).
研究資金:
1. 日本学術振興会・最先端・次世代研究開発支援プログラム、課題番号LS130、平成22〜25年度、研究代表者。
2. うま味調味料技術部会・研究助成、平成25〜27年、研究代表者。
ⒸJASRI
(Received: August 27, 2018; Early edition: November 28, 2018; Accepted: December 17, 2018; Published: January 25, 2019)